实验3-3 植物体中某些元素的检验 知识点题库
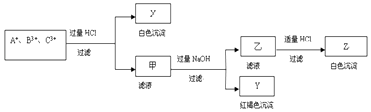
请通过分析回答(用化学符号填写):
-
(1) A+是,B3+是,C3+是;
-
(2) X是,Y是,Z是;
-
(3) 写出下列离子方程式:
①生成Y沉淀:;②B3+与过量氨水反应:;
-
(4) 写出下列化学方程式:单质铝和Y分解后的固体产物反应:.
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量 Na2CO3溶液 ⑤加过量 BaCl2溶液.

已知:该实验条件下,各金属离子沉淀的pH如图2所示.下列判断正确的是( )
序号 | 物质(杂质) | 所用试剂 | 分离方法 |
A | 甲烷(乙烯) | 溴水 | 洗气 |
B | 氢氧化钠溶液(氢氧化钙溶液) | 二氧化碳 | 过滤 |
C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
D | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |

-
(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③。
-
(2) 设V(Cl2)/V(CH4)=x , 若理论上欲获得最多的氯化氢,则x的值应为。
-
(3) D装置的石棉中均匀混有KI粉末,其作用是。
-
(4) E装置的作用是(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
-
(5) E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为。该装置存在的缺陷是没有进行尾气处理,其尾气的主要成分为(填编号)。
A.CH4 B.CH3Cl
C.CH2Cl2 D.CHCl3
E.CCl4
| 实验步骤和方法 | 实验结论 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有CDE三种液体不溶解而浮在水上层 |
| ③分别取少量7种液体于试管,加新制的Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F能产生砖红色沉淀 |
| ④各取C、D、E少量于试管中加稀NaOH溶液并加热 | 都有分层现象,C加热不变化,D、E加热后不分层,但D加热后闻到特殊香味 |
给试剂瓶重新贴上标签依次的名称是 :A、B、C、D、E、F、G。

-
(1) 写出反应Ⅱ的离子方程式 。
-
(2) 从反应IV的铵明矾溶液中获得铵明矾晶体的实验操作依次为、、过滤、洗涤(填操作名称)。
-
(3) 反应Ⅵ的化学方程式为。
-
(4) 废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是 。
|
相对分子质量 |
熔点/℃ |
沸点/℃ |
溶解性 |
|
|
甲苯 |
92 |
-94.9 |
110.6 |
难溶于水 |
|
苯甲酸 |
122 |
122.13 |
249 |
微溶于水 |
|
苯甲酸钠 |
144 |
— |
249.3 |
易溶于水 |
按下列合成步骤回答问题:
⑴制备苯甲酸
在三颈瓶中加入4mL甲苯和20mL蒸馏水,再加入5mL浓硫酸,放入碎瓷片后,加热至沸腾,加入  高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
高锰酸钾,加热到甲苯层消失。将三颈瓶在冰水浴中冷却,分离出苯甲酸.
⑵制备苯甲酸钠
控制温度为70℃,向三颈瓶中加入  苯甲酸和适量的
苯甲酸和适量的  的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
的碳酸钠溶液,充分反应后停止加热.在深色的溶液中加入活性炭,并将反应混合物过滤,得到无色透明的苯甲酸钠溶液,将滤液转入蒸发皿中,加热蒸发、冷却结晶,过滤、洗涤、干燥制得苯甲酸钠晶体.
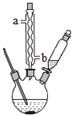
①球形冷凝管的作用是 ,其进水口是  填“a”或“b”
填“a”或“b”  .
.
②三颈瓶中反应的离子方程式 .
③分离苯甲酸选用的玻璃仪器是  填标号
填标号 
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
④分离出的苯甲酸晶体中可能含有的杂质是 ,为进一步提纯,应采用的方法是 .
⑤控制温度为70℃的方法是 .
⑥加入活性炭的作用是 .
[查阅资料] ①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;②2B+6HCl  2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
[设计实验] 某同学设计如图所示装置制备三氯化硼:

请回答下列问题:
-
(1) 常温下,可用高锰酸钾与浓盐酸发生的反应可替代A装置中的反应,请写出高锰酸钾与浓盐酸反应的离子方程式: 。
-
(2) E装置的作用是。如果拆去B装置,可能的后果是。
-
(3) 三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式。实验室保存三氯化硼的注意事项是。
-
(4) 实验中可以用一个盛装(填试剂名称)的干燥管代替F和G装置,使实验更简便。
-
(5) 为了顺利完成实验,正确的操作是(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯 ②同时点燃A、D处酒精灯 ③先点燃D处酒精灯,后点燃A处酒精灯
-
(6) 请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
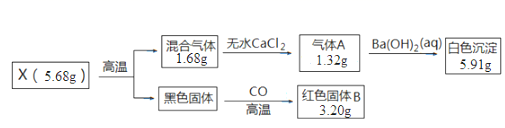
-
(1) 混合气体的成分是。
-
(2) X的化学式为。
-
(3) 写出CuCl2与Na2CO3反应生成X的离子方程式。

-
(1) “溶解”步骤反应的离子方程式为.温度宜控制在50℃左右,若高于50℃,溶液中O2溶解量减少、Cu的转化率降低,若低于50℃ ,
-
(2) “反应”步骤生成Cu2(OH)2CO3的化学方程式为。反应后溶液中铜元素残留量受pH和反应时间的影响如图所示:
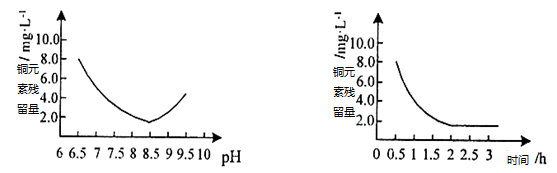
判断反应的最佳条件: pH为、反应时间为h。
-
(3) 检验Cu2(OH)2CO3洗涤是否完全的方法是
-
(4) Cu2(OH)2CO3也可以表示为CuCO3·Cu(OH)2。 查阅文献,上述反应条件下还可能生成少量CuCO3·Cu(OH)2。为测定产品的纯度[产品中Cu2(OH)2CO3的质量分数],取10.97g干燥样品,400℃左右加热,测得固体质量随时间变化关系如图所示。

已知: 8.00g固体为黑色纯净物。
有关物质的摩尔质量如表:
物质
CuCO3·Cu(OH)2
CuCO3·2Cu(OH)2
CuO
摩尔质量/g·mol-1
222
320
80
请计算产品的纯度(写出计算过程,结果保留3位有效数字)。


已知:CoC2O4• 2H2O 微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的  离子生成
离子生成  而溶解。
而溶解。
-
(1) “煅烧1”的主要目的是。
-
(2) “还原酸浸”过程中Co2O3发生反应的离子方程式为 。
-
(3) “除铁、铝”过程的两种试剂的作用分别是。
-
(4) “沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(
 ):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是。
):n(Co2+) 比值的增加,钴的沉淀率又逐渐减小的原因是。②沉淀反应时间为10min,当温度高于50℃以上时,钴的沉淀率下降的原因可能是。
-
(5) 为了获得较为纯净的CoC2O4•2H2O,“操作X”的实验操作为。
-
(6) 已知煅烧CoC2O4•2H2O时温度不同,产物不同。400℃时在空气中充分煅烧,得到钴的氧化物质量为2.41g,CO2的体积为1.344L(标准状况下),则此时所得钴的氧化物的化学式为 。
-
(7) 利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2
 C6+ LiCoO2 , 其工作原理如图。则充电时LiCoO2的电极反应式为。
C6+ LiCoO2 , 其工作原理如图。则充电时LiCoO2的电极反应式为。 
 已知:I.PbS不溶于强碱溶液,但可以被H2O2氧化为PbSO4;
已知:I.PbS不溶于强碱溶液,但可以被H2O2氧化为PbSO4; Ⅱ.PbSO4和PbS共热可以产生Pb且两者的物质的量之比为1:1。
-
(1) 硫铅矿石预先粉碎的目的是。
-
(2) 步骤②的操作中需要用到玻璃棒,其作用是,该过程中发生反应的离子方程式为:。
-
(3) 滤渣Ⅱ的主要成分是(填化学式)。
-
(4) 步骤③发生反应的化学方程式为,该步骤一般需控制较低的温度,其原因是,将该步骤的残液与滤液Ⅱ混合,会产生的现象是。
-
(5) 步骤⑤发生反应的化学方程式为。
 、NO、
、NO、 、
、 、
、 、
、 中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则有关甲气体的组成判断不正确的为(不考虑
中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则有关甲气体的组成判断不正确的为(不考虑 与
与 、NO的反应)( )
、NO的反应)( )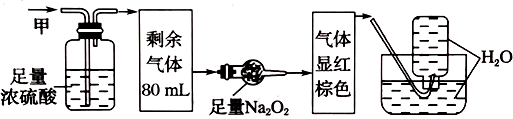
 、
、 、
、 B . 一定含
B . 一定含 , 其体积为20mL
C . 一定含
, 其体积为20mL
C . 一定含 , 其体积为48mL
D . 一定含NO,其体积为20mL
, 其体积为48mL
D . 一定含NO,其体积为20mL



