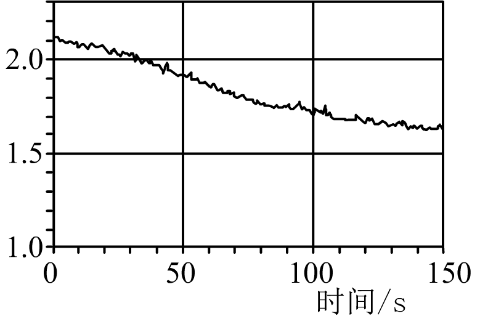
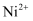实验3-4 酸碱滴定曲线的测绘 知识点题库
食物 | 泡菜 | 葡萄 | 番茄 | 苹果 | 牛奶 | 玉米粥 |
pH | 3.4 | 4.2 | 4.4 | 3.1 | 6.5 | 7.8 |
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B | AgI沉淀中滴入稀KCl溶液 | 有白色沉淀出现 | AgCl比AgI更难溶 |
C | Al箔插入稀HNO3中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
①.把pH试纸浸入待测溶液中,测定溶液的pH
②.用渗析法除去Fe(OH)3胶体中的Cl﹣离子
③.苯酚沾在皮肤上,应立即用酒精清洗
④.称NaOH固体质量时,将NaOH固体放在垫有滤纸的托盘上进行称量
⑤.用分液漏斗分离除去溴苯中混入的溴
⑥.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出.
⑦.用酒精萃取碘水中的碘.

 增大
D . 25℃时,CH3COOH的电离平衡常数Ka=
增大
D . 25℃时,CH3COOH的电离平衡常数Ka= 
选项 | 实验操作 | 现象 | 结论 |
A | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 | 测定醋酸钠溶液pH |
B | 向盐酸中滴入少量NaAlO2溶液 | 无明显现象 | AlO2-与H+未发生反应 |
C | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
D | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀。 | 苯酚浓度小 |
| B | 测定醋酸溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显红色。 | 醋酸溶液显酸性 |
| C | 向20%蔗糖溶液中加入少量稀H2SO4 , 加热;再加入银氨溶液;未出现银镜。 | 蔗糖未水解 |
| D | 向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色。 | 溶液中含Br2 |
①用pH试纸测得氯水的pH为2 ②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
-
(1) 25℃时,CH3COOH和NH3×H2O的电离常数相等。取10mL0.1mol×L-1醋酸溶液测得其pH=3。0.1mol×L-1氨水(NH3×H2O溶液)的pH=。用pH试纸测定该氨水pH的操作方法为。
-
(2) 某温度(t℃)时,测得0.01 mol×L-1的NaOH溶液的pH=11,则该温度下水的KW=。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,若所得混合液为中性,且a+b=12,则Va: Vb。
-
(3) 25℃时,0.1 mol×L-1的HA溶液中
 。请回答下列问题:
。请回答下列问题: ①HA是(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是(填字母)。
a.c(HA) b.
 c.c(H+)与c(OH-)的乘积 d.c(OH-)
c.c(H+)与c(OH-)的乘积 d.c(OH-)
 ,还含有一定量的
,还含有一定量的  、
、  、
、  、
、 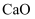 、
、  等)制备草酸钴晶体
等)制备草酸钴晶体  的工业流程如下图所示。请回答下列问题:
的工业流程如下图所示。请回答下列问题: 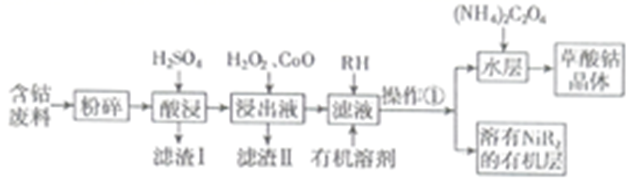
已知:①草酸钴晶体难溶于水
② 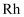 为有机物(难电离)
为有机物(难电离)
③相关金属离子 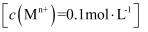 形成氢氧化物沉淀的
形成氢氧化物沉淀的  范围如下:
范围如下:
| 金属离子 | | | | |
| 开始沉淀的 | 7.5 | 2.7 | 3.4 | 6.9 |
| 沉淀完全的 | 9.0 | 3.7 | 4.7 | 8.9 |
-
(1) 滤渣Ⅰ的成分。
-
(2)
 是一种绿色氧化剂,写出加入
是一种绿色氧化剂,写出加入  后溶液中发生的主要反应的离子方程式。
后溶液中发生的主要反应的离子方程式。
-
(3) 加入氧化钴调节浸出液的
 的范围是。
的范围是。
-
(4) 加入有机溶剂的目的是。
-
(5) 若仅从沉淀转化角度考虑,能否利用反应
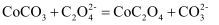 将
将 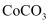 转化为
转化为  (填“能”或“不能”),说明理由:。(已知
(填“能”或“不能”),说明理由:。(已知  ,
,  )
)
-
(6) 为测定制得的草酸钴晶体样品的纯度,现称取样品
 ,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液
,先用适当试剂将其转化,稀释后得到纯净的草酸铵溶液  。移取
。移取 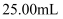 该溶液加入过量的稀硫酸酸化,用
该溶液加入过量的稀硫酸酸化,用 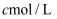 高锰酸钾溶液滴定,当溶液由(填颜色变化),消耗高锰酸钾溶液
高锰酸钾溶液滴定,当溶液由(填颜色变化),消耗高锰酸钾溶液 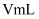 ,计算草酸钴晶体样品的纯度为
,计算草酸钴晶体样品的纯度为 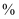 。(用含
。(用含 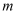 、
、 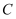 、
、 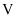 的代数式表示)(已知
的代数式表示)(已知  的摩尔质量为
的摩尔质量为 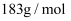 )
)