实验3-4 酸碱滴定曲线的测绘 知识点题库
加氨水体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
溶液的pH | 4 | 4 | 4 | 4 | 6 | 8 | 10 | 10 | 10 |
利用上述记录的数据,以加入的氨水体积为横坐标、pH为纵坐标绘制曲线图,并根据曲线图回答下列问题:
-
(1) 所测土壤的酸碱性如何?
-
(2) 所用氨水的pH和c(OH﹣)分别为多少?
-
(3) 为使该滤液呈中性,所加入氨水的恰当体积是多少?

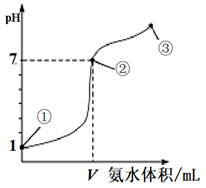
 )
D . 在点②、③之间可能存在:c(NH
)
D . 在点②、③之间可能存在:c(NH  )>c(Cl-)=c(OH-)>c(H+)
)>c(Cl-)=c(OH-)>c(H+)
| 选项 | 实验 | 现象 | 结论 |
| A | 常温下,测定饱和CH3COONa和NaNO2溶液的pH | pH(NaNO2)<pH(CH3COONa) | HNO2酸性大于CH3COOH |
| B | 向含有酚酞的Na2CO3溶液中滴加少量BaCl2固体 | 溶液颜色变浅 | Na2CO3溶液中存在水解平衡 |
| C | 向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaCl,再滴加2滴0.01 mol/ LNaBr溶液 | 先产生白色沉淀,然后产生黄色沉淀 | Ksp(AgCl)>Ksp(AgBr) |
| D | 把固体AgCl加入到较浓的KI溶液 | 白色固体变黄 | AgCl溶解度小于AgI |
-
(1) 该学生的操作是(填“正确的”或“错误的”),理由是。
-
(2) 若用此方法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是。
-
(3) 该学生用此方法测定下列溶液的pH,其中测定结果无误差的是________(填序号)A . NaOH溶液 B . CH3COONa溶液 C . NaCl溶液 D . NaHSO4溶液
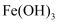 胶体:将
胶体:将  浓溶液滴加到饱和的
浓溶液滴加到饱和的  溶液中
B . 检验溶液中的
溶液中
B . 检验溶液中的  取一根洁净的铂丝,放在酒精灯外焰上灼烧至与原来的火焰颜色相同时为止,再蘸取少量试液,在外焰上灼烧,透过蓝色钴玻璃观察,若火焰呈紫色,则含有
取一根洁净的铂丝,放在酒精灯外焰上灼烧至与原来的火焰颜色相同时为止,再蘸取少量试液,在外焰上灼烧,透过蓝色钴玻璃观察,若火焰呈紫色,则含有  C . 测定
C . 测定  溶液
溶液 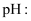 用玻璃棒蘸取溶液,点在湿润的
用玻璃棒蘸取溶液,点在湿润的  试纸上
D . 配制
试纸上
D . 配制 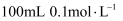 氯化钠溶液:称取
氯化钠溶液:称取 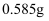 氯化钠固体,放入
氯化钠固体,放入 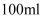 量筒中,加水定容至
量筒中,加水定容至 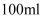 刻度线
刻度线

|
选项 |
实验目的 |
实验方法 |
相关解释 |
|
A |
测量氯水的pH |
|
pH试纸遇酸变红 |
|
B |
测量锌粒和3mol/L硫酸反应生成 |
|
|
|
C |
探究正戊烷 |
|
|
|
D |
用 |
|
|
实验内容 | 实验目的 | |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18 mol·L-1和0.1 mol·L-1H2SO4溶液的pH | 比较不同浓度硫酸的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有2 mL 0.01 mol·L-1 AgNO3溶液的试管中滴加2滴0.01 mol·L-1 NaCl溶液,有白色沉淀生成,再向其中滴加 2滴0.01 mol·L-1 NaI溶液,产生黄色沉淀 | 证明在相同温度下Ksp(AgCl)>Ksp(AgI) |

 的体积
的体积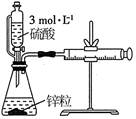
 会与锌粒反应生成
会与锌粒反应生成  催化裂解
催化裂解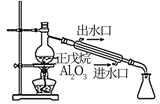
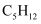 裂解为分子较小的烷烃和烯烃,可以冷凝收集
裂解为分子较小的烷烃和烯烃,可以冷凝收集 溶液制备
溶液制备 



