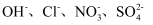实验4-2 金属镁、铝、锌化学性质的探究 知识点题库
在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及其硫酸盐的信息,用以证明火星上存在或曾经存在过水,以下叙述正确的是
A . Fe2O3与Fe3O4互为同素异形体
B . 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤 →向滤液中滴加KSCN溶液
C . 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D . 明矾属硫酸盐,含结晶水,是混合物
下列各组物质与其用途的关系不正确的是( )
A . 过氧化钠﹣﹣供氧剂
B . 金属镁﹣﹣制照明弹
C . 苏打﹣﹣发酵粉主要成分
D . 明矾﹣﹣净水剂
能实现下列物质间直接转化的元素是( )
单质  氧化物
氧化物 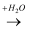 酸或碱
酸或碱 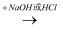 盐.
盐.
A . Si
B . Na
C . Al
D . Fe
下列有关金属的说法中,正确的是( )
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用;
②纯铁比生铁抗腐蚀性更强;
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属;
④正常人体缺钙会引起骨质疏松症,缺铁会引起贫血等疾病;
⑤青铜、不锈钢、硬铝都是合金;
⑥可通过焰色反应区分钾元素和钠元素.
A . ②④⑤⑥
B . ②③④⑤
C . ①③④⑤
D . ①②⑤⑥
将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.

-
(1) 原合金中Mg、Al的质量各是多少?
-
(2) 盐酸的物质的量浓度是多少?
-
(3) 取过滤后所得滤渣,向其中加入足量1mol/L NaOH溶液,可生成标准状况下0.112LH2 , 则a的最小值是多少?
已知:a、b、c三物质间有转化关系a→b→c→a,物质间转化均只需要一步反应便能完成,则a、b、c不可能是( )
A . a:Fe b:FeCl3 c:FeCl2
B . a:AlCl3 b:Al(OH)3 c:Al2O3
C . a:N2 b:NH3 c:NO2
D . a:SO2 b:SO3 c:H2SO4
铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6 , 六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
-
(1) 铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明) .
-
(2) 将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是 。
-
(3) 下列关于氧化铝的叙述正确的是( )A . 氧化铝可以治疗胃酸过多。 B . 氧化铝因为熔点高,可以作耐火材料. C . 氧化铝是铝热剂的成分之一。 D . 氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
-
(4) 某工厂排放出有毒物质NOCl , 它遇水就会生成NO3―。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。水源中的NO3―对人类健康会产生危害。为了降低水源中NO3―的浓度,有研究人员建议在碱性条件下用铝粉将NO3―还原为N2 , 该反应的离子方程式为,此方法的缺点是处理后的水中生成了AlO2― , 仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。已知25℃时,Ksp[Al(OH)3] =1.3×10-33 Al(OH)3
 AlO2-+H++H2O K=1.0×10-13 , 25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH= 。此时水中c(Al3+)=
AlO2-+H++H2O K=1.0×10-13 , 25℃时,若欲使上述处理后的水中AlO2―浓度降到1.0×10-6mol/L,则应调节至pH= 。此时水中c(Al3+)=
下列有关厨房中铝制品使用合理的是( )
A . 盛放食醋
B . 用碱水洗涤
C . 烧煮开水
D . 用金属丝擦洗表面的污垢
以下物质间的每步转化,不能通过一步反应实现的是( )
A . S→SO2→SO3
B . Al→Al2O3→Al(OH)3
C . Fe→FeCl2→Fe(OH)2
D . NH3→NO→NO2
将  和
和  的样品溶解在过量的
的样品溶解在过量的 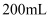 物质的量浓度为
物质的量浓度为 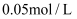 的
的  溶液中,然后向其中加入
溶液中,然后向其中加入  溶液使
溶液使  、
、  刚好完全沉淀,用去
刚好完全沉淀,用去  溶液
溶液 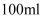 ,则
,则  溶液的浓度为( )
溶液的浓度为( )
 和
和  的样品溶解在过量的
的样品溶解在过量的 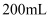 物质的量浓度为
物质的量浓度为 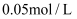 的
的  溶液中,然后向其中加入
溶液中,然后向其中加入  溶液使
溶液使  、
、  刚好完全沉淀,用去
刚好完全沉淀,用去  溶液
溶液 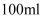 ,则
,则  溶液的浓度为( )
溶液的浓度为( )
A . 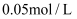 B .
B . 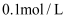 C .
C .  D .
D . 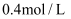
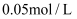 B .
B . 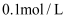 C .
C .  D .
D . 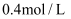
下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是( )
A . 氧化镁中混有氧化铝
B . 氯化铝溶液中混有氯化铁
C . 氯化亚铁溶液中混有氯化铜
D . 氧化铁中混有二氧化硅
下列物质既能与盐酸又能与氢氧化钠溶液反应的是( )
①Al ②Al2O3 ③ Al(OH)3 ④NaHCO3
A . ①②
B . ②③
C . ①②③
D . ①②③④
下列说法错误的是( )
A . 碳酸钠可用于去除餐具的油污
B . 氢氧化铝可用于中和胃酸过多
C . 二氧化硅可用作计算机芯片
D . 铝合金大量用于高铁建设
下列有关说法正确的是( )
A . H3PO2与足量的NaOH反应生成NaH2PO2 , 则NaH2PO2属于酸式盐
B . SOCl2与六水合三氯化铝混合并加热可得到无水的三氯化铝
C . T℃时,在一体积为V L的密闭容器中放入一定量的PCl5固体,发生:PCl5(s)  PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D . 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D . 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
 PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D . 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
PCl3(g)+Cl2(g),若保持温度不变,达平衡后给容器加压,达新平衡后,容器内的总压将降低
D . 粗铜的电解精炼过程中,若阳极质量减少10克,则阴极质量增加10克
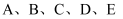 是中学常见的几种化合物,相关物质间的转化关系如图所示:
是中学常见的几种化合物,相关物质间的转化关系如图所示: 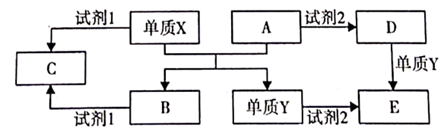
已知: 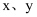 是生活中常见的金属单质,
是生活中常见的金属单质, 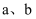 都是氧化物且A是红棕色粉末。回答下列问题:
都是氧化物且A是红棕色粉末。回答下列问题:
-
(1) 单质X与A反应的化学方程式是。
-
(2) 若试剂1和试剂2均为强电解质。
①若试剂1为强碱,则试剂1与B反应的离子方程式为。
②若试剂1和试剂2为同种物质,则C溶液显(填“酸性”、“碱性”或“中性”)。
-
(3) 若试剂2是稀硝酸。
①写出单质Y与稀硝酸反应生成E的离子方程式。
②可用于检验D的阳离子的试剂是。
下列说法错误的是( )
A . 实验室盛放碱溶液的试剂瓶应使用橡胶塞
B . 沙子、石英、水晶、玛瑙都是天然存在的二氧化硅
C . 豆科植物把含氮化合物转变为蛋白质属于氮的固定
D . 常温下,可以用铁或铝制容器来盛装浓硝酸或浓硫酸
化学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
A . 碳酸钠可用于制作糕点的膨松剂,是因为加热能分解出二氧化碳
B . 电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法
C . 含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
D . 高纯铝被大量用于制造火箭、导弹和飞机的外壳
下表中,陈述Ⅰ、Ⅱ都正确且两者之间有关联的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 不能用pH试纸测新制氯水的pH | H+有氧化性 |
| B | Al(OH)3能在NaOH溶液中溶解 | Al(OH)3是两性氢氧化物 |
| C | 盐酸中逐滴滴入Na2CO3溶液,立即产生大量气泡 | 氯元素的非金属性比碳强 |
| D | FeSO4溶液保存时加入少量铜粉 | Fe的金属性比Cu强 |
A . A
B . B
C . C
D . D
现有A、B、C、D四种可溶性物质,它们溶于水后电离产生的所有离子如下表所示:(各物质中所含离子均不相同)
|
阳离子 |
|
| 阴离子 | |
已知
①A溶液呈碱性;
②实验室常用B的浓溶液制取化工原料氯气;
③B溶液与C溶液混合有白色沉淀产生;
④向D溶液中逐滴滴加A溶液至过量,有白色沉淀产生,且沉淀量先增加后减少但不消失。
回答下列问题:
-
(1) 写出下列物质的化学式:A ,C 。
-
(2) B溶液与C溶液混合后发生反应的离子方程式为。
-
(3) 写出④中沉淀减少发生反应的离子方程式。
-
(4) 设计实验检验D中所含的阴离子:。
下列说法正确的是( )
A . 金属钠着火,可以用干粉灭火器灭火
B . 铁主要以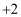 价和
价和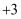 价化合物的形态存在于矿石之中,游离态的铁单质存在于陨铁中
C . 铝制餐具可以用来长时间存放酸性或碱性食物
D . 储氢合金指的是能够用物理吸附的方法吸收氢气的合金,如镧镍合金等
价化合物的形态存在于矿石之中,游离态的铁单质存在于陨铁中
C . 铝制餐具可以用来长时间存放酸性或碱性食物
D . 储氢合金指的是能够用物理吸附的方法吸收氢气的合金,如镧镍合金等
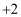 价和
价和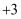 价化合物的形态存在于矿石之中,游离态的铁单质存在于陨铁中
C . 铝制餐具可以用来长时间存放酸性或碱性食物
D . 储氢合金指的是能够用物理吸附的方法吸收氢气的合金,如镧镍合金等
价化合物的形态存在于矿石之中,游离态的铁单质存在于陨铁中
C . 铝制餐具可以用来长时间存放酸性或碱性食物
D . 储氢合金指的是能够用物理吸附的方法吸收氢气的合金,如镧镍合金等
最近更新