第一单元 氯、溴、碘及其化合物 知识点题库
选项 | 已知 | 解释与结论 |
A | 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 | Al作正极,Cu作负极 |
B | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 该反应在常温下能自发进行 | 该反应的△H<0 |
C | 常温下,Ksp(AgCl)=1.8×10﹣10、 Ksp(AgBr)=5.4×10﹣13 | 向BaCl2溶液中加入AgNO3和KBr,当AgCl、AgBr两种沉淀共存时, |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,振荡,溶液变为黄色 | 氧化性:H2O2>Fe3+ |

-
(1) 研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2 , 其过程如图1所示。过程①的化学方程式是。在过程②中每产生0.1molO2 , 转移电子mol。

-
(2) 在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键
C=O
H—H
C—H
O—H
键能/(kJ•mol-1)
745
436
413
463
则CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H=kJ•mol-1。
CH4(g)+2H2O(g) △H=kJ•mol-1。②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2 , 控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为;温度T1 下,该反应的化学平衡常为。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是(填字母)。
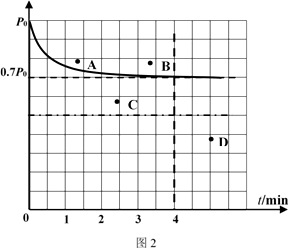
-
(3) 工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)
 Ni(CO)4(g) △H<0 Ni(CO)4(g)
Ni(CO)4(g) △H<0 Ni(CO)4(g)  Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为(填化学式)。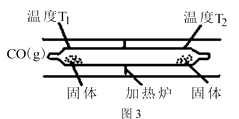
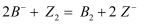 ②
② 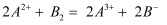 ③
③ 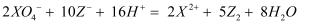 ,根据上述反应,判断下列结论中正确的是()
,根据上述反应,判断下列结论中正确的是()
-
(1) 化学与生产生活密切相关,请写出下列反应
①实验室制氯气(离子方程式)
②“腐蚀法”制作印刷电路板(化学方程式)并用双线桥表示该反应的电子转移数目和方向
-
(2) K2FeO4可用作水处理剂,它可由以下反应制得:
Cl2 + Fe(OH)3 + OH- = FeO4 2-+ Cl- + H2O
配平此反应方程式。当1mol K2FeO4生成时,转移的电子数目为
 被还原为Mn2+ ,
被还原为Mn2+ ,
-
(1) 写出反应的离子方程式
-
(2) 若31.6gKMnO4与过量浓盐酸充分反应,被氧化的HCl的物质的量为,在标准状况下生成的Cl2的体积为。
-
(3) 用生成的氯气通入下面的装置来验证氯气的某些性质。

用离子方程式解释C中有色布条褪色的原因:;D是用来检验氯气性质的实验,可观察到溶液由无色变为蓝色(I2单质遇淀粉变蓝色),请比较Cl2、I2、KMnO4的氧化性,由强到弱为。
 还原
还原  的实验(固定装置略)。
的实验(固定装置略)。 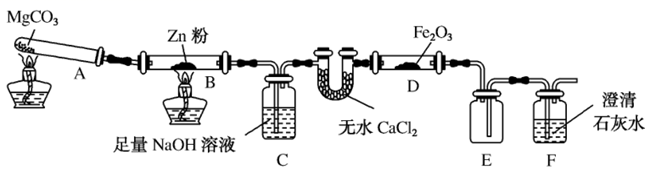
-
(1) 写出装置B中发生反应的化学方程式。
-
(2) 用酒精喷灯对装置D加热,得到灰黑色粉末,用灰黑色粉末进行以下实验:
步骤
操作
现象
1
取灰黑色粉末加入稀硫酸
溶解,有气泡
2
取步骤1中溶液,滴加
 溶液后,在空气中,搅拌放置
溶液后,在空气中,搅拌放置白色沉淀最终变为红褐色
3
取步骤1中溶液,滴加
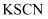 溶液
溶液无现象
4
向步骤3溶液中滴加新制氯水至过量
先变红,后褪色
①得到的灰黑色粉末一定有(填写化学式)。
②步骤2中“白色沉淀最终变为红褐色”的化学反应方程式为。
③步骤4中,溶液变红的原因为
 被氧化为
被氧化为  ,
,  遇
遇 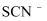 显红色;写出
显红色;写出  被氧化的离子方程式;溶液褪色的可能原因是
被氧化的离子方程式;溶液褪色的可能原因是 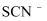 可能被
可能被  氧化;验证上述原因的实验操作方法为。
氧化;验证上述原因的实验操作方法为。 -
(3) 上述装置,从实验安全考虑,需要采取的改进措施是。
-
(4) 聚合硫酸铁(铁元素均为+3价)可用于水的净化,其化学式可表示为
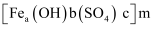 。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份,一份溶液中加入足量的
。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份,一份溶液中加入足量的  溶液,得到白色沉淀
溶液,得到白色沉淀 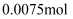 ,另一份溶液,先将
,另一份溶液,先将  还原为
还原为  ,再用
,再用  标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗  标准溶液
标准溶液 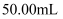 。该聚合硫酸铁样品中
。该聚合硫酸铁样品中  的比值为。(没有计算过程不得分)(已知:
的比值为。(没有计算过程不得分)(已知: 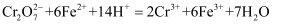 )
)
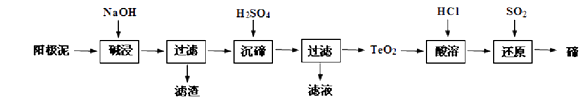
 、Zn、ZnO、Co、Ni等)中回收有价值的金属具有重要意义。
、Zn、ZnO、Co、Ni等)中回收有价值的金属具有重要意义。 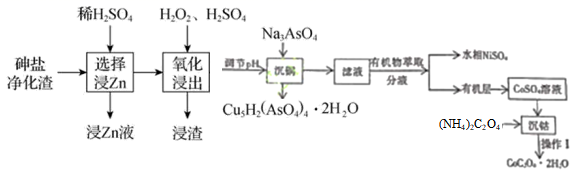
回答下列问题:
-
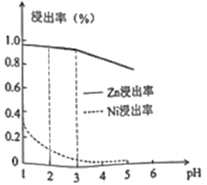
(1) “选择浸Zn”过程中,为了提高Zn的浸出率可采取的措施有(写两点),其他条件不变时,Zn和Ni浸出率随pH变化如下图所示,则“选择浸Zn”过程中,最好控制溶液的pH为。
-
(2) “氧化浸出“时,
 被氧化为
被氧化为  的化学方程方式为;此过程温度不能过高的原因。
的化学方程方式为;此过程温度不能过高的原因。
-
(3) 用NaOH溶液调节氧化浸出液至弱酸性,再加入
 进行“沉铜”,得到难溶性的
进行“沉铜”,得到难溶性的  ,则“沉铜”的离子方程式为。
,则“沉铜”的离子方程式为。
-
(4) 操作Ⅰ所用到的玻璃仪器有,已知煅烧
 时温度不同,产物不同。400℃时在空气中充分煅挠,得到的钴的氧化物的质量为4.82g,
时温度不同,产物不同。400℃时在空气中充分煅挠,得到的钴的氧化物的质量为4.82g,  的体积为2.688L(标准状况下),则此时所得钴的氧化物的化学式为。
的体积为2.688L(标准状况下),则此时所得钴的氧化物的化学式为。
-
(5) 已知常温下,相关金属氢氧化物开始沉淀和沉淀完全(离子浓度
 视为沉淀完全)的pH如下表所示:
视为沉淀完全)的pH如下表所示: 开始沉淀的pH
完全沉淀的pH

8.0
10.0

7.5
9.5
若将沉铜后的溶液调节至
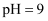 ,此时溶液中
,此时溶液中 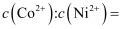 。
。
-
(1) I.氯化铁可用于金属蚀刻,污水处理。
25℃时,FeCl3溶液的pH7(填“>”、“<”或“=”),原因是(用离子方程式表示)。把FeCl3溶液蒸干灼烧得到的主要产物是。
-
(2) 为了探究外界条件对氯化铁水解平衡的影响,某研究性学习小组设计实验方案,获得如下数据:
实验
c(FeCl3)/mol·L−1
V (FeCl3)/ mL
温度/℃
pH
1
0.1
5
25
x
2
0.1
5
35
y
3
0.2
5
25
z
下列说法正确的是_______(填序号)。
A . 上述实验能判断出温度对氯化铁水解的影响 B . 表格中x > y > z C . 上述实验能得出:增大盐的浓度,水解平衡正向移动,水解程度越大 -
(3) II.滴定实验是化学学科中最重要的定量实验之一、葡萄酒中抗氧化剂残留量的测定,常采用氧化还原滴定法。葡萄酒常用Na2S2O3作抗氧化剂,测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

往实验中加入盐酸的目的是将Na2S2O3转化成SO2;滴定过程中发生的反应是:I2+SO2+2H2O=2HI+H2SO4
加入盐酸时发生反应的离子方程式为。
-
(4) 滴定时,I2溶液应装在(“酸”或“碱”)式滴定管中,该滴定过程的指示剂是,滴定终点的现象为。
-
(5) 实验消耗标准I2溶液50.00ml,所测样品中抗氧化剂的残留量(以游离SO2计算)为g·L-1。
-
(6) 下列情形会造成测定结果偏高的是_______(填序号)。A . 滴定持续时间稍长,溶液中部分HI被空气氧化 B . 盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗 C . 滴定前平视,滴定后俯视 D . 滴定前滴定管尖嘴有气泡滴定后气泡消失
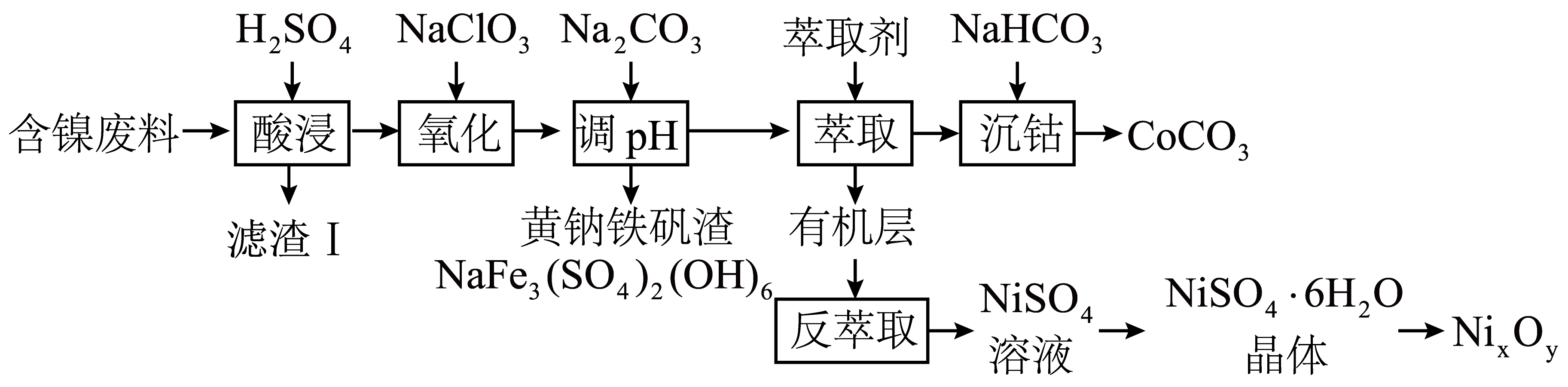
已知:Ksp[Co(OH)2]=2×10-15 , 请回答以下问题:
-
(1) “滤渣I”主要成分是。
-
(2) “氧化”时反应的离子方程式是,为证明添加NaClO3已足量,可用(写化学式)溶液进行检验。
-
(3) “调pH”过程中生成黄钠铁钒沉淀,该反应的离子方程式为。
-
(4) “萃取”和“反萃取”可简单表示为:2HX+Ni2+
 NiX2+2H+。在萃取过程中加入适量氨水,其作用是。“反萃取”需要往有机层中加(填试剂名称)。
NiX2+2H+。在萃取过程中加入适量氨水,其作用是。“反萃取”需要往有机层中加(填试剂名称)。
-
(5) 若起始时c(Co2+)=0.02mol∙L-1 , “沉钴”过程中应控制pH<7.5的原因是。
-
(6) 资料显示,硫酸镍结晶水合物的形态与温度有如表关系。
温度
低于30.8℃
30.8℃~53.8℃
53.8℃~280℃
高于280℃
晶体形态
NiSO4•7H2O
NiSO4•6H2O
多种结晶水合物
NiSO4
由NiSO4溶液获得稳定的NiSO4•6H2O晶体的操作依次是蒸发浓缩、、过滤、洗涤、干燥。

-
(1) CeCO3F其中Ce元素的化合价为。
-
(2) “焙烧”过程中可以加快反应速率,提高焙烧效率的方法是(写出一种即可)。
-
(3) 操作①所需的玻璃实验仪器有烧杯、。
-
(4) 上述流程中盐酸可用硫酸和H2O2替换,避免产生污染性气体Cl2 , 由此可知氧化性;CeO2 H2O2 (填“>”,“<”)
-
(5) 写出“沉铈”过程中的离子反应方程式。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5 mol/L,此时溶液的pH为5,则溶液中c(
 )=mol/L(保留2位有效数字)。(已知常温下Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×10-28)。
)=mol/L(保留2位有效数字)。(已知常温下Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×10-28)。
-
(6) Ce4+溶液可以吸收大气中的污染物NOx减少空气污染,其转化过程如图所示(以NO2为例)
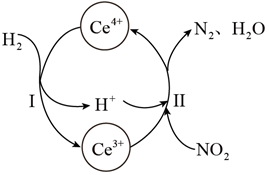
①该反应中的催化剂为(写离子符号)
②该转化过程中氧化剂与还原剂物质的量之比为。
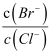 =3×10﹣3
=3×10﹣3


