第一单元 氯、溴、碘及其化合物 知识点题库
下列氧化还原反应中,水作为还原剂的是( )
A . Cl2+H2⇌HCl+HClO
B . Br2+SO2+2H2O=H2SO4+2HBr
C . 2F2+2H2O=4HF+O2
D . CaO+H2O=Ca(OH)2
下列反应中气体作氧化剂的是( )
A . SO3通入水中:SO3+H2O=H2SO4
B . Cl2通入FeCl2溶液中:Cl2+2FeCl2=2FeCl3
C . HCl通入NaOH溶液中:HCl+NaOH=NaCl+H2O
D . CO2通入NaOH溶液中:CO2+2NaOH=Na2CO3+H2O
NaH中的氢元素为﹣1价,它可用作生氢剂,反应的化学方程式是NaH+H2O═NaOH+H2↑.则下列说法正确的是( )
A . NaOH是氧化产物
B . 当1molNaH发生反应时,该反应转移电子的物质的量为2mol
C . NaH为还原剂
D . H2O既是还原剂又是氧化剂
雅典奥运会上使用的发令枪,所用火药的成分是氯酸钾和红磷,经撞击发出响声并同时产生白色烟雾,此时发生的反应为:5KClO3+6P═3P2O5+5KCl,则下列有关叙述错误的是( )
A . 上述反应中消耗3molP时,转移15mol电子
B . 上述反应中氧化剂和还原剂的物质的量之比是5:6
C . 产生白色烟雾的原因是生成的P2O5为白色小颗粒(烟)吸水性很强,吸收空气中水分,部分生成磷酸小液滴(雾)
D . 因红磷和白磷互为同素异形体,所以在此火药中可以用白磷代替红磷
常温下KMnO4氧化浓HCl的反应方程式如下:
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
-
(1) 用“双线桥法”标明反应中电子转移的方向和数目.
-
(2) 又已知MnO2+4HCl(浓)
 MnCl2+Cl2+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:.
MnCl2+Cl2+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:.
-
(3) 若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为 mol,产生的Cl2在标准状况下的体积为 L.
下列叙述中,正确的是( )
A . 氧化还原反应的本质是元素化合价发生了变化
B . 含化合价升高元素的反应物被氧化
C . 得到电子的物质被氧化
D . 氧化还原反应中,氧化剂和还原剂一定是两种物质
以下对电子转移的方向和数目的表示正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为氯气与氨气反应的装置.
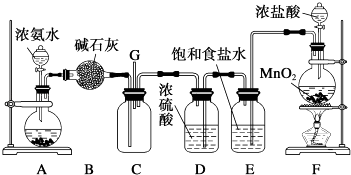
请回答下列问题:
-
(1) B装置的名称是;
-
(2) 装置A的烧瓶中可装试剂;
-
(3) 装置F中发生反应的化学方程式为;
E装置的作用是;
-
(4) 装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:.
-
(5) 从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?.
下列过程与氧化还原反应无关的是( )
A . 植物的光合作用
B . 钢铁生锈
C . 米饭变馊
D . SO2使品红溶液褪色
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ. 打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ. 当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ. 当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
-
(1) A中产生黄绿色气体,其电子式是。
-
(2) 验证氯气的氧化性强于碘的实验现象是。
-
(3) B中溶液发生反应的离子方程式是。
-
(4) 为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是。
-
(5) 过程Ⅲ实验的目的是。
-
(6) 氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,得电子能力逐渐减弱。
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如图所示。

-
(1) “苦卤”到“含Br2的海水”过程(填“是”或“不是”)氧化还原反应。
-
(2) 步骤④利用了SO2的还原性,反应的离子方程式为。
-
(3) 步骤⑥的蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,其原因是。
-
(4) 若处理1 m3海水需要消耗0.45 molSO2 , 不考虑转化过程中溴的损耗,则海水中溴离子的物质的量浓度为。
-
(1) 在标准状况下,4.48LCH4和CO2的混合气体质量为6.0g,则该混合气体的平均摩尔质量为,其中CH4和CO2的物质的量之比为。
-
(2) 将17.1gBa(OH)2溶解在水中,配成100mL溶液,配好后从中取出10mL溶液,加水稀释至100mL,则稀释后所得溶液中OH-的物质的量浓度是mol/L。
-
(3) 在标准状况下,VL某气体(摩尔质量为M g/mol)溶解在1L水(水的密度近似为1g/cm3)中,假设气体完全溶解且不与水发生反应,所得溶液的密度为ρg/cm3 , 则所得溶液的物质的量浓度c=mol/L(用以上字母表示,且必须化简)。
-
(4) 实验室用MnO2与浓盐酸制取Cl2 , 发生反应的化学方程式:。ClO2处理水时被还原成Cl- , 不生成有机氯代物等有害物质。工业上用亚氯酸钠和稀盐酸为原料制备ClO2反应:NaClO2+HCl→ClO2↑+NaCl+H2O。写出配平的化学方程式。生成0.2molClO2转移的电子数目为。
-
(5) 取体积相同的KI、Na2SO3、FeBr2溶液,分别通入足量氯气,当恰好完全反应时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2溶液的物质的量浓度之比为。如果向FeBr2溶液中通入等物质的量的Cl2 , 该反应的离子方程式为。
配平下列方程式并填空。
-
(1) Cu+HNO3=Cu(NO3)2+NO↑+H2O,该反应中氧化剂和还原剂的质量之比为。
-
(2)
 +H2O2+= Mn2++O2 ↑+H2O
+H2O2+= Mn2++O2 ↑+H2O
氧化还原反应的实质是( )
A . 分子中的原子重新组合
B . 氧元素的得失
C . 电子的得失或共用电子对的偏移
D . 化合价的改变
海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。部分流程如图:
 请回答下列问题:
请回答下列问题:
-
(1) 请写出海水淡化的两种方法:、。
-
(2) 通入热空气吹出Br2 , 利用了Br2的(填序号)。
a.氧化性 b.还原性c.挥发性
-
(3) 操作Ⅰ用SO2水溶液吸收Br2有关反应的离子方程式为。
-
(4) 写出操作Ⅱ通氯气后发生的离子方程式。
-
(5) 为使母液中的MgCl2转化为Mg(OH)2 , 从原料来源及经济效益角度考虑,试剂①最好选用。
a.氨水 b.氢氧化钙c.氢氧化钠
-
(6) 操作Ⅲ的化学方程式为。
在石墨材料性能提升的帮助下,锂离子电池的性能也得到了大幅提升,华为公司曾开发出石墨烯锂离子电池,其工作原理如图1所示,该锂离子电池正极铝钴膜主要含有 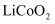 、
、 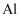 等,处理该正极废料的一种流程如图2所示:
等,处理该正极废料的一种流程如图2所示:
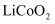 、
、 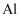 等,处理该正极废料的一种流程如图2所示:
等,处理该正极废料的一种流程如图2所示: 
请回答下列问题:
-
(1) “碱浸”时发生反应的离子方程式为。
-
(2) 滤渣的主要成分的化学式为。
-
(3) “酸溶”时
 的作用是,“酸溶”时温度不宜过高的原因是。盐酸可以代替
的作用是,“酸溶”时温度不宜过高的原因是。盐酸可以代替  和
和  的混合液,但工业上都不采用盐酸,其原因是。
的混合液,但工业上都不采用盐酸,其原因是。
-
(4) 用图1中锂离子电池作电源电解制备
 的装置如图3所示,d与锂离子电池的极相连(填“a”或“b”),电解池中发生的总反应离子方程式为。当锂离子电池中有
的装置如图3所示,d与锂离子电池的极相连(填“a”或“b”),电解池中发生的总反应离子方程式为。当锂离子电池中有 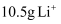 移向正极时,电解池中阴极区溶液质量的变化量为g。
移向正极时,电解池中阴极区溶液质量的变化量为g。
下列方案设计、现象和结论都正确的是( )
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究 | 取少量浓硝酸加热分解,将产物先通入浓硫酸,后用集气瓶收集气体 | 将带火星的木条放置瓶内,木条复燃,不能说明 |
| B | 鉴别NaCl和 | 分别取少量溶液于试管中,然后滴加酸性的 | 若紫红色退去,则该溶液为NaCl溶液 |
| C | 向盛有 | 溶液变成棕黄色,一段时间后产生气泡,随后生成红褐色沉淀。 | |
| D | 探究淀粉在酸性条件下的水解程度 | 取少量淀粉溶液,加入适量稀硫酸加热5min后,再加NaOH中和硫酸,最后滴加碘水 | 溶液无明显现象,则淀粉完全水解 |
A . A
B . B
C . C
D . D
过去电子工业常用30%的FeCl3溶液腐蚀覆有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为3FeCl3+Cu=2FeCl2+CuCl2。
-
(1) 检验腐蚀后的溶液中含有Fe3+应选用的试剂是,上述反应说明Fe3+、Cu2+氧化性的强弱关系为。
-
(2) 采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液的流程如图所示。
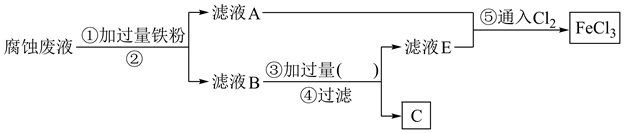
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为,③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。
化学基本概念是学习化学的基石,请正确回答下列问题。
-
(1) 今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。
属于电解质的是,属于非电解质的是能导电的是 。
-
(2) “四种基本反应类型与氧化还原反应的关系”如图所示:
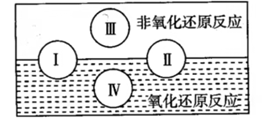
其中I为化合反应,IV是反应。
-
(3) 我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+ 2KNO3 +3C=K2S+N2↑+3CO2↑,反应中被还原的物质是(填化学式)。
-
(4) NaH可在野外作生氢剂,反应原理为NaH+H2O=NaOH+ H2↑,该反应中氧化产物和还原产物的质量比为。
-
(5) 15.6gNa2X含有0.2molX2- , 含有Na+的物质的量是,Na2X的摩尔质量为。
-
(6) 工业制备漂白粉原理是(用化学方程式表示)。
兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含 、
、 , 还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
, 还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
 、
、 , 还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
, 还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知: ,
, 
-
(1) “酸溶”过程中,
 发生反应的离子方程式为。
发生反应的离子方程式为。
-
(2) “除杂”过程中加入
 除去
除去 发生的反应是:
发生的反应是: , 该反应的平衡常数
, 该反应的平衡常数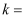 。
。
-
(3) “沉镍”所得沉淀有多种组成,可表示为
 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品 , 隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
, 隔绝空气加热,剩余固体质量随温度变化的曲线如图所示( 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种, 以上残留固体为
以上残留固体为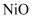 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)
-
(4) “浸出”是制备兰尼镍的关键步骤,
 溶液在“浸出”过程中的作用是。
溶液在“浸出”过程中的作用是。
-
(5) 使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是。
最近更新
 能否支持燃烧
能否支持燃烧 溶液
溶液 被
被  ;
;  ,且反应放热,促进了
,且反应放热,促进了 


