第一单元 氯、溴、碘及其化合物 知识点题库
磷及部分重要化合物的相互转化如图所示.

①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是;
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol/L CuSO4溶液所能氧化的白磷的物质的量为.
-
(1) 用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
-
(2) 钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:
①CaC2O4+H2SO4=H2C204+CaSO4
②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
上述反应②的还原剂是;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂 mol,有 mol电子发生转移,相当于测出含钙元素的质量是 g.
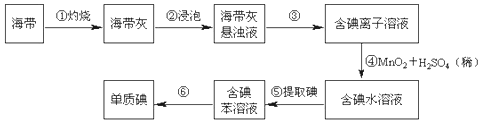
现有下列仪器,请按要求填写以下空白:
-
(1) 其中适用于物质分离的仪器有(填名称),使用前需要检验是否漏水的有(填序号).

-
(2) 步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处).A . 烧杯 B . 坩埚 C . 表面皿 D . 泥三角 E . 酒精灯 F . 干燥器
-
(3) 步骤③除铁架台、烧杯外,还需用到的仪器有;
-
(4) 步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是,上图中还缺少的玻璃仪器是.
-
(1) 写出该反应的化学方程式.
-
(2) 若要制取纯净干燥的氯气,应使气体依次通过装有和的洗气瓶.
-
(3) 该小组称取8.7g二氧化锰与足量10mol•L﹣1的浓盐酸反应,理论上可制得氯气的体积(标准状况)V1=L.
-
(4) 若该小组量取了10mol•L﹣1的浓盐酸40mL,与足量的二氧化锰反应,理论上产生氯气的体积为V2(标准状况),则V1V2(填“>”、“=”或“<”)

-
(1) 已知部分弱酸的电离常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离常数
(25 ℃)
Ka=1.77×10-4
Ka=5.0×10-10
Ka1=4.3×10-7
Ka2=5.6×10-11
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;
B.HCN;
C.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)。
③向NaCN溶液通入少量CO2反应的化学方程式是。
-
(2) ①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是;此时c(HCN)/c(CN-)=。
②HCN溶液有挥发性,HCN是有剧毒的物质,实验室在做有关NaCN的实验时尽量不采用的实验条件是。
A、冰水浴 B、加热 C、浓溶液 D、稀溶液 E、酸性条件 F、碱性条件
③常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是。

-
(1) 煅烧时生成的主要气体产物是 ,浸出渣A的主要成分是。
-
(2) 红土镍矿煅烧后生成的Ni2O3有强氧化性,加压酸浸时有无色无味的气体产生且有NiSO4生成,则该反应中氧化产物与还原产物的物质的量之比为。
-
(3) 向浸出液A中加入适量Na2S,发生氧化还原反应的离子方程式为。
-
(4) 若Na2S过量,则过滤出的固体中会混有;H2S也可代替Na2S使用,但不利之处是。
-
(5) 已知Ni(CO)4的沸点是42.2℃,Ni(s)+CO(g)
 Ni(CO)4(g)的平衡常数与温度关系如下:
Ni(CO)4(g)的平衡常数与温度关系如下: 温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
步骤①、步骤②的最佳温度分别是、 (选填项代号)。
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
-
(6) 加氢氧化钠的目的是溶解部分铝,形成多孔结构的镍铝合金,已知红土镍矿中NiS质量分数45.5%,取1kg红土镍矿进行制备,熔融时加入270g铝,浸出时消耗800mL5mol/LNaOH,理论上生成的兰尼镍的化学式为。
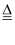 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
-
(1) 用双线桥标出电子转移的方向和数目。
-
(2) 此反应的氧化剂是,还原剂是。
-
(1) I.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

氧原子核外有种运动状态不同的电子;碘原子最外层电子的排布式为;K2CO3固体中含有的化学键有。
-
(2) 合成步骤中的化学方程式为。
-
(3) 当合成温度高于70℃,碘酸钾产率会降低,请写出可能的两种原因:。
-
(4) Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
该反应的氧化产物为,若反应过程中有4 mol HCl参与反应,则电子转移的数目为。
-
(5) Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
向浓缩的海水中通入Cl2 , 将海水中的Br-氧化为Br2。“氧化”时先在卤水中加入硫酸酸化,然后再通入氯气,硫酸酸化可以提高氯气的利用率,原因是。
-
(6) 用热空气将Br2从上述溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2。吸收1 mol Br2需消耗Na2CO3mol。
-
(1) 著名的Vanviel反应为12H2S+6CO2
 C6H12O6+6H2O+12S↓,该反应的能量转化形式是,每生成1molC6H12O6。转移电子的数目为。
C6H12O6+6H2O+12S↓,该反应的能量转化形式是,每生成1molC6H12O6。转移电子的数目为。
-
(2) 脱除H2S最早的方法是可再生吸附法。其吸附原理如图。

①下列说法错误的是。
a.脱除H2S总反应的热效应△H=△H1+△H2
b.Fe2O3·H2O是该反应的吸附剂,降低了反应的活化能
c.Fe2S3·H2O可使反应的焓变减小
d.为了实现转化需要不断补充Fe2O3·H2O和Fe2S3·H2O
②脱硫过程中反应的化学方程式为;再生过程中,氧化剂与氧化产物的质量比为。
-
(3) 不同温度下(其他条件相同)发生反应2H2S(g)
 2H2(g)+S2(g),间隔相同时间测定一次H2S的转化率(未达到平衡),如图所示:
2H2(g)+S2(g),间隔相同时间测定一次H2S的转化率(未达到平衡),如图所示: 
①温度越高,H2S的转化率越接近平衡时的转化率,是因为。
②初始在恒容密闭容器中只充入H2S,在900℃时发生反应,平衡时气体总压强为pPa,则N点v(正)(填“>”“<”或“=”)v(逆);对应温度下反应的平衡常数Kp=Pa(Kp为以分压表示的平衡常数,列出含p的代数式。)
 =FeAsO3↓,Fe3++AsO
=FeAsO3↓,Fe3++AsO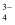 =FeAsO4↓。
=FeAsO4↓。已知:①三价砷的毒性高于五价砷;
②Ksp(FeAsO3)>Ksp(FeAsO4);
③K2FeO4具有较强的氧化性。pH越小,其氧化性越强,稳定性越弱。
-
(1) pH约为7时,为除去废水中的砷,下列试剂中去除效果较好的是(填序号)。
A.FeCl3 B.K2FeO4 C.FeCl3、K2FeO4
选择该试剂的理由是。
-
(2) 一定条件下,以K2FeO4去除废水中的砷,溶液的pH对砷去除率的影响如图1所示:

①当pH>8时,pH越大,砷去除率越低,其原因可能是。
②当pH<5时,pH越小,砷去除率越低,其原因可能是。
-
(3) Na2S2O8易溶于水、有氧化性,利用Fe—Na2S2O8体系去除废水中的五价砷,反应机理如图2所示。

已知:•OH(羟基自由基)是一种不带电荷的活性中间体,“•”表示未成对电子。
①写出•OH的电子式。
②S2O
 在此过程中的作用与发生的变化可描述为。
在此过程中的作用与发生的变化可描述为。



