第2章 元素与物质世界 知识点题库
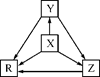
| 选项 | X | Y | Z | R |
| A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
| B | Na | Na2O | Na2O2 | NaOH |
| C | H2S | S | SO2 | SO3 |
| D | N2 | NH3 | NO | NO2 |
 HClO+H++Cl-
B . 制备硝基苯的化学方程式:
HClO+H++Cl-
B . 制备硝基苯的化学方程式: 

-
(1) 蓝色沉淀的化学式为,使淀粉溶液变蓝的物质的电子式为。
-
(2) 固体甲与稀硫酸反应的离子方程式为。
-
(3) 流程中生成白色沉淀的离子方程式为。
-
(1) 含砷黄铁矿(主要成分为FeAsS)高温焙烧氧化后,再用氰化钠(NaCN)溶液浸出。已知:氢氰酸(HCN)易挥发,有剧毒。
①焙烧氧化的产物有As4O6、Fe3O4 , 该反应的化学方程式为。
②焙烧氧化的缺点为。
③采用电解法除去反应剩余液中有毒物质,CN-在阳极区被去除。在pH=10时,CN-去除效果最佳且能耗最低,原因是。
-
(2) 利用细菌进行生物氧化提取金,pH对金的浸出率影响如图-1,pH影响金浸出率的原因是。

-
(3) 湿法氧化是在溶液中化学物质的作用下提取金。已知Au的硫酸盐难溶于水,Au+与
 、
、 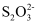 等形成配合物。
等形成配合物。 ①工业上利用硫代硫酸盐可浸出金生成Au(S2O3)
 ,但在富氧条件下浸出率明显降低,原因是。
,但在富氧条件下浸出率明显降低,原因是。②常温下,已知H2S-HS--S2-粒子体系随pH变化各组分分布如图-2,δ(H2S)=
 。多硫化物浸金的一种原理是:混合体系在通空气条件下氧化时,体系中S2-先被氧化为S,再转化为
。多硫化物浸金的一种原理是:混合体系在通空气条件下氧化时,体系中S2-先被氧化为S,再转化为  。研究发现
。研究发现  可将Au氧化为AuS- , pH=11时
可将Au氧化为AuS- , pH=11时  将Au氧化的离子方程式为。
将Au氧化的离子方程式为。
 B . 向KI与稀硫酸的混合溶液中通入氧气:
B . 向KI与稀硫酸的混合溶液中通入氧气:  C . 已知还原性
C . 已知还原性  ,a mol
,a mol  溶液中通入a mol
溶液中通入a mol  :
:  D . 在澄清石灰水中加入过量的碳酸氢钠溶液:
D . 在澄清石灰水中加入过量的碳酸氢钠溶液: 
 B . Cu与浓硝酸反应:
B . Cu与浓硝酸反应:  C . 向碳酸钙中滴加醋酸溶液:
C . 向碳酸钙中滴加醋酸溶液:  D .
D .  溶液中加入铁粉:
溶液中加入铁粉: 

回答下列问题:
-
(1) 实验一:FeC2O4·2H2O晶体的制备
打开K1、K3和K4 , 关闭K2 , 向装置A中加入稍过量的稀硫酸。
①A中溶液由无色逐渐变为浅绿色,该反应的离子方程式为。
②同时A中有气体产生,该气体的作用是。
-
(2) 收集H2并验纯后,打开K2 , 关闭,让A中浅绿色溶液流入B中,以生成FeC2O4 , 分离得FeC2O4·2H2O晶体。
-
(3) 实验二:K3[Fe(C2O4)3]的制备
将实验一得到的FeC2O4·2H2O溶于水,加入H2O2、H2C2O4和K2C2O4 , 酒精灯微热并不断搅拌,反应制得K3[Fe(C2O4)3]。
①写出该反应的化学方程式。
②“微热、搅拌”的目的是;若加热温度太高,对反应造成的主要影响是。
③从上述反应后的溶液中分离得到K3[Fe(C2O4)3]·3H2O晶体,测定所得产品的纯度:称取a g晶体溶于100 mL水中配成溶液,取20 mL溶液于锥形瓶中,用c mol·L-1的酸性K2Cr2O7标准溶液进行滴定(
 被还原为Cr3+),进行了三次平行实验,达到滴定终点时平均消耗标准溶液V mL,则所得产品的纯度为%(用含V、c、a的代数式表示)。
被还原为Cr3+),进行了三次平行实验,达到滴定终点时平均消耗标准溶液V mL,则所得产品的纯度为%(用含V、c、a的代数式表示)。
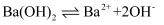 B . 钢铁发生吸氧腐蚀时的正极反应:
B . 钢铁发生吸氧腐蚀时的正极反应: 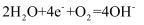 C . Na2S水解的离子方程式:
C . Na2S水解的离子方程式: 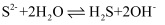 D . 电解NaCl溶液的离子方程式:
D . 电解NaCl溶液的离子方程式: 
 溶液刻蚀铜制印刷电路板
D . 从海水中提取粗盐
溶液刻蚀铜制印刷电路板
D . 从海水中提取粗盐

 变成
变成 需要加氧化剂
B .
需要加氧化剂
B .  转化成
转化成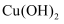 需要加碱
C . 如果将高铜酸根离子(
需要加碱
C . 如果将高铜酸根离子( )填入坐标,应该填在
)填入坐标,应该填在 的位置
D . 在酸性环境中,
的位置
D . 在酸性环境中, 可以歧化成
可以歧化成 和
和
-
(1) 下列给定的物质中:①
 ②铝条 ③熔融氯化钠 ④乙醇。属于电解质的是(填编号)。
②铝条 ③熔融氯化钠 ④乙醇。属于电解质的是(填编号)。
-
(2) 写出金属钠投入水中反应的化学方程式。
-
(3) 比较沸点:

 (填“>”“<”“=”)。
(填“>”“<”“=”)。
 )时,加服维生素C效果更好,因维生素C具有还原性
B . 胶粒不能透过半透膜,血液透析利用半透膜将有害粒子移出体外
C . 小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多
D . 过氧化钠既可用作呼吸面具中氧气的来源,又可漂白织物等
)时,加服维生素C效果更好,因维生素C具有还原性
B . 胶粒不能透过半透膜,血液透析利用半透膜将有害粒子移出体外
C . 小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多
D . 过氧化钠既可用作呼吸面具中氧气的来源,又可漂白织物等
 转化为重要化工原料
转化为重要化工原料 的原理示意图,下列说法错误的是( )
的原理示意图,下列说法错误的是( )
 , 发生氧化反应
C . 当正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为NA
D . 催化剂a表面的电极反应式为:
, 发生氧化反应
C . 当正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为NA
D . 催化剂a表面的电极反应式为:
 会带来环境污染问题,用微生物法和铁炭法均可将
会带来环境污染问题,用微生物法和铁炭法均可将  还原脱除。
还原脱除。
-
(1) 微生物法脱硫
富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中
 还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。①
 的空间构型为。
的空间构型为。②CH3COOH与
 在SBR细菌作用下生成CO2和H2S的离子方程式为。
在SBR细菌作用下生成CO2和H2S的离子方程式为。③将H2S从水中吹出时,用CO2比N2效果更好,其原因是。
-
(2) 铁炭法脱硫
铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的
 转化为硫化物沉淀除去。
转化为硫化物沉淀除去。①废水中
 转化为硫化物而除去,该硫化物的化学式为。
转化为硫化物而除去,该硫化物的化学式为。②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15 min后溶液pH缓慢下降的原因可能是。

-
(3) 处理后废水中
 含量测定
含量测定 准确量取50.00 mL水样于锥形瓶中,加入10.00 mL 0.0500 mol·L-1BaCl2溶液,充分反应后,滴加氨水调节溶液pH= 10,用0.0100 mol·L-1 EDTA (Na2H2Y) 溶液滴定至终点,滴定反应为:Ba2++H2Y2- =BaY2-+2H+ , 平行滴定3次,平均消耗EDTA溶液27.50 mL。计算处理后水样中
 含量。(用mg·L-1表示,写出计算过程)。
含量。(用mg·L-1表示,写出计算过程)。

-
(1) 根据图中信息,写出+5价氯的氧化物的化学式:。
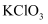 属于物质类别中的。
属于物质类别中的。
-
(2) 写出高氯酸(
 )与NaOH反应的化学方程式:。
)与NaOH反应的化学方程式:。
-
(3) HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式:。
②浓盐酸可作为还原剂在加热条件下与
 发生反应制备
发生反应制备 , 写出该反应的化学方程式:。
, 写出该反应的化学方程式:。 -
(4)
 既具有氧化性,又具有还原性。请结合上图说明原因。
既具有氧化性,又具有还原性。请结合上图说明原因。



