第2章 元素与物质世界 知识点题库
-
(1) KClO3 在 673K 时可分解为固体 A 和固体 B(物质的量之比为 3∶1),其中固体 A 所含元素与 KClO3 完全相同。写出相应的化学反应方程式 。比较KClO3 和固体 A 的热稳定性:KClO3固体 A(填“>”、“<”或“=”)。
-
(2) NaCN 各原子均满足 8 电子稳定结构。写出 NaCN 的电子式。

-
(1) 写出图一原电池的负极的电极反应式:。反应过程中,SO42-移向电极;
-
(2) 当图一的电解质溶液为NaCl溶液时,该电池的正极的电极反应式为:;
-
(3) 图二的原电池放电一段时间后,当在铜片上放出2.24L(标准状况)气体时,H2SO4恰好消耗一半。则产生这些气体的同时,共消耗g锌,此时转移的电子数目为 ,原硫酸的物质的量浓度是 (设溶液体积不变)。
![]() +KMnO4→
+KMnO4→ 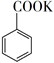 + MnO2
+ MnO2 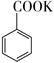 +HCl→
+HCl→ 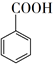 +KCl
+KCl
|
名称 |
相对分 子质量 |
熔点/℃ |
沸点/℃ |
密度/(g·mL−1) |
溶解性 |
|
甲苯 |
92 |
−95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
—— |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
-
(1) 根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A . 100 mL B . 250 mL C . 500 mL D . 1000 mL
-
(2) 在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。
-
(3) 加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。
-
(4) “用少量热水洗涤滤渣”一步中滤渣的主要成分是。
-
(5) 干燥苯甲酸晶体时,若温度过高,可能出现的结果是。
-
(6) 本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。
A.70% B.60% C.50% D.40%
-
(7) 若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。
①2KMnO4  K2MnO4+MnO2+O2↑;②2KClO3
K2MnO4+MnO2+O2↑;②2KClO3 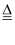 2KCl+3O2↑;③2H2O2 =2H2O+O2↑若要制得相同质量的氧气,①②③反应中电子转移数目之比为( )
2KCl+3O2↑;③2H2O2 =2H2O+O2↑若要制得相同质量的氧气,①②③反应中电子转移数目之比为( )
①NaHCO3②(NH4)2CO3③Al2O3④Al(OH)3⑤Al
 已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
已知: ① Fe(OH)3开始沉淀的 pH值为2.7,沉淀完全时的 pH值为3.7。
② 对浸出渣的处理,直至得到产品,都在封闭的管道内进行。
③ pH>3,则 BiCl3极易水解生成不溶性的 BiOCl 沉淀。
请回答以下问题:
-
(1) 铋精矿在浸取时会先进行粉碎,目的是。
-
(2) 加压氧化氨浸过程中,已知 CuS2发生如下反应:
 ,
,  生成
生成  ,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式。
,FeS2在此过程中也生成某氧化物,请写出发生反应的化学方程式。
-
(3) 操作Ⅰ为:。
-
(4) 根据流程分析,盐酸羟胺在反应中起到什么作用:。
-
(5) 流程中生成 BiOCl 的离子方程式:。
-
(6) 滤液 3 中含有的金属阳离子有:。
 D . 0.01 mol·L-1 NaN3溶液中: c(H+)+ c(Na+ )= c( N
D . 0.01 mol·L-1 NaN3溶液中: c(H+)+ c(Na+ )= c( N  )+ c(HN3)
)+ c(HN3)
 为阿伏加德罗常数,则下列说法错误的是( )
为阿伏加德罗常数,则下列说法错误的是( )
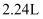 环己烷的分子数为
环己烷的分子数为  B .
B . 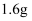 甲烷完全燃烧生成二氧化碳和水,转移的电子数为
甲烷完全燃烧生成二氧化碳和水,转移的电子数为  C .
C .  乙烯和环丙烷混合物中含有的碳原子数为
乙烯和环丙烷混合物中含有的碳原子数为  D .
D .  乙炔分子中含有的共用电子对数为
乙炔分子中含有的共用电子对数为 
 +H2↑
C . 用浓NaOH溶液溶解Al2O3:OH-+Al2O3=
+H2↑
C . 用浓NaOH溶液溶解Al2O3:OH-+Al2O3=  +H2O
D . 往氯化铁溶液中滴加氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓
+H2O
D . 往氯化铁溶液中滴加氢氧化钠溶液:Fe3++3OH-=Fe(OH)3↓
 、
、  、
、  、K+
B . Na+、Ba2+、Ca2+、
、K+
B . Na+、Ba2+、Ca2+、  C . Mg2+、
C . Mg2+、  、K+、Cl-
D . K+、Ba2+、Na+、
、K+、Cl-
D . K+、Ba2+、Na+、 
 B . Na+、Al3+、Cl-、Ba2+
C . OH-、Al3+、Cl-、NO
B . Na+、Al3+、Cl-、Ba2+
C . OH-、Al3+、Cl-、NO  D . Na+、Ba2+、Cl-、NO
D . Na+、Ba2+、Cl-、NO 

-
(1) 装置I可用于制取Cl2 , 写出该反应的化学方程式。
-
(2) 装置II的作用是。
-
(3) 装置IV中a处红色纸条无明显变化,b处红色纸条褪色,同学猜测使b处红色纸条褪色的物质是。
-
(4) 装置V中NaOH溶液可吸收Cl2并制得漂白液(有效成分:NaClO),写出该反应的离子方程式。
-
(5) 该小组同学查阅资料,发现:
①NaClO溶液具有氧化性,能使红色纸条褪色
②溶液的pH会影响NaClO溶液的漂白效果
该小组同学利用市售“84”消毒液(主要成分:NaClO)探究不同pH下红色纸条褪色的情况,实验如下:
实验方案
实验现象
1.将市售“84”消毒液稀释至溶液的pH=12.
2.取20mLpH=12的稀释液各3份,分别用H2SO4溶液将pH调至10、7和4(液体积变化忽略不计)。
3.分别放入大小相同的红色纸条。
pH=10
10min后,红色纸条基本不褪色;4h后红色褪去。
pH=7
10min后,红色纸条颜色变浅;4h后红色褪去。
pH=4
10min后,红色纸条颜色变得更浅;4h后红色褪去。
已知:溶液中HClO、ClO-物质的量分数(a)随溶液pH变化的关系如下图所示:

①由实验现象可知:溶液的pH在4~10范围内,pH越大,红纸褪色。
②结合图像分析pH=7和pH=4的溶液,现象差异的原因。
③结合实验现象和图像可知,氧化性:HClONaClO(填“>”或“<”)。“84”消毒液主要成分是NaClO而不是HClO,因为HClO不稳定,不易保存。写出HClO见光分解的化学方程式 。
综上所述,HClO能使红色纸条褪色,“84”消毒液在酸性环境下漂白效果更佳。
 B . 二氧化锰和浓盐酸反应:
B . 二氧化锰和浓盐酸反应: C . 碳酸氢铵溶液与足量氢氧化钡溶液反应:
C . 碳酸氢铵溶液与足量氢氧化钡溶液反应: D . 足量二氧化硫通入氢氧化钠溶液中:
D . 足量二氧化硫通入氢氧化钠溶液中:
 溶液与盐酸反应:
溶液与盐酸反应: B .
B .  与
与 溶液反应:
溶液反应: C . 澄清石灰水与过量小苏打溶液混合:
C . 澄清石灰水与过量小苏打溶液混合: D . 过量
D . 过量 气体通入氢氧化钠溶液中:
气体通入氢氧化钠溶液中:
 和
和 :
: B . 向碳酸氢钠溶液中滴加少量石灰水:
B . 向碳酸氢钠溶液中滴加少量石灰水: C . 同物质的量浓度同体积的
C . 同物质的量浓度同体积的 溶液与
溶液与 溶液混合:
溶液混合: D . 用亚硫酸钠溶液吸收少量氯气:
D . 用亚硫酸钠溶液吸收少量氯气:
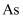 是重要的氮族元素,氮族元素的单质及其化合物的应用较为广泛。回答下列问题:
是重要的氮族元素,氮族元素的单质及其化合物的应用较为广泛。回答下列问题:
-
(1)
 与P位于同一主族,磷原子的结构示意图为,砷在周期表中的位置是。
与P位于同一主族,磷原子的结构示意图为,砷在周期表中的位置是。
-
(2) 下列能说明N和P非金属性相对强弱的是____(填标号)。A .
 比
比 稳定性强
B .
稳定性强
B .  溶液与
溶液与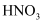 反应生成
反应生成 C . 硝酸显强氧化性,磷酸不显强氧化性
D . 常温下,氮气是气体,磷单质是固体
C . 硝酸显强氧化性,磷酸不显强氧化性
D . 常温下,氮气是气体,磷单质是固体
-
(3)
 比
比 稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,
稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂, 发生水解的化学方程式为。
发生水解的化学方程式为。
-
(4) 白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜反应如下:
 , 反应中
, 反应中 可氧化
可氧化 。
。



