第2章 元素与物质世界 知识点题库
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | ||||||
| 1 | ① | |||||||||||||
| 2 | ② | ③ | ④ | ⑤ | ||||||||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
-
(1) 表中化学性质最不活泼的元素,其原子结构示意图为 。
-
(2) ②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是,最高价氧化物的水化物中酸性最强的是 。
-
(3) 第三周期元素形成的简单离子中半径最小的微粒是,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式、 。
-
(4) 元素③的氢化物的电子式是;该氢化物与元素⑩的氢化物发生反应的化学方程式。
-
(5) 用电子式分别写出元素⑩与元素②、⑥形成化合物过程 、。
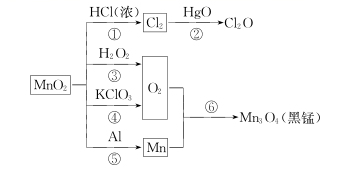
回答下列问题:
-
(1) 上述反应中MnO2作氧化剂的是(填序号,下同),作催化剂的是。
-
(2) 写出上述反应中属于离子反应的离子方程式:。
-
(3) 相同条件下生成等体积的O2 , 反应③和④转移的电子数之比为。
-
(4) 反应⑤中氧化剂与还原剂的物质的量之比为。
-
(5) 反应②的化学方程式为3Cl2+2HgO
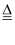 Hg+HgCl2+2Cl2O,若生成8.7gCl2O,则转移的电子的物质的量为mol
Hg+HgCl2+2Cl2O,若生成8.7gCl2O,则转移的电子的物质的量为mol
 2KCl+3O2↑
B . 3CO+Fe2O3
2KCl+3O2↑
B . 3CO+Fe2O3  2Fe+3CO2
C . CaCO3+SiO2
2Fe+3CO2
C . CaCO3+SiO2  CaSiO3+CO2↑
D . Zn+H2SO4=ZnSO4+H2↑
CaSiO3+CO2↑
D . Zn+H2SO4=ZnSO4+H2↑
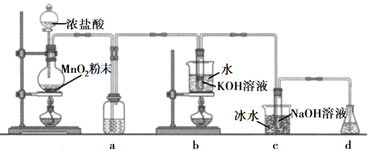
回答下列问题:
-
(1) 盛放MnO2粉末的仪器名称是,a中的试剂为。
-
(2) b中采用的加热方式是,c中化学反应的离子方程式是,采用冰水浴冷却的目的是。
-
(3) d的作用是,可选用试剂(填标号)。
A.Na2S B.NaCl C.Ca(OH)2 (悬浊液) D.H2SO4
-
(4) 反应结束后,取出b中试管,经冷却结晶,,,干燥,得到KClO3晶体。
-
(1) 12.4 g Na2R含Na+0.4 mol,则Na2R的摩尔质量为,R的相对原子质量为。
-
(2) 书写下列离子方程式
①把碳酸钡固体投入盐酸中 ;
②向石灰乳中通入少量CO2 ;
③稀盐酸中加入适量铁粉。
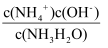 一定增大
一定增大
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用铜电极电解饱和KCl溶液 | 有气体生成 | Cl-的失电子能力比OH-强 |
| B | Cl2通入石蕊试液 | 溶液先变红后褪色 | Cl2具有酸性和漂白性 |
| C | 对H2(g)+I2(g) | 气体颜色加深 | 加压平衡向生成I2(g)的方向移动 |
| D | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,并有黑色颗粒产生 | CO2具氧化性 |
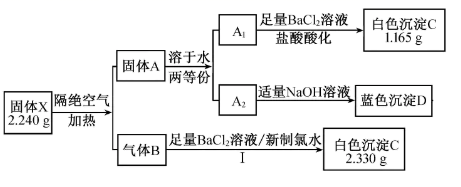
其中:A和B均为纯净物;B可使品红溶液褪色。
请回答:
-
(1) 白色沉淀C的化学式是。
-
(2) 组成X的3种元素是 (填元素符号),X 的化学式是。
-
(3) 步骤I中发生反应的离子方程式是。
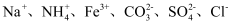 中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( ) 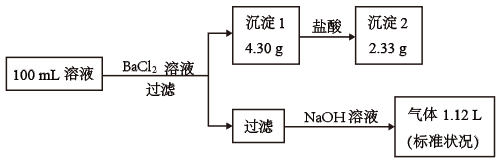
 和
和  ,可能存在Fe3+
D . 溶液中可能存在的离子有
,可能存在Fe3+
D . 溶液中可能存在的离子有 

 稀溶液冲洗
B . 过程I中氧化产物和还原产物的物质的量之比为5∶6
C . 过程II中,除生成
稀溶液冲洗
B . 过程I中氧化产物和还原产物的物质的量之比为5∶6
C . 过程II中,除生成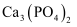 外,还可能生成
外,还可能生成 、
、 D . 过程III的化学方程式为
D . 过程III的化学方程式为
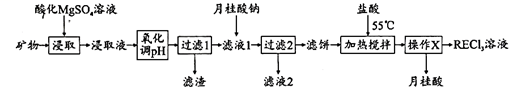
已知:月桂酸  熔点为
熔点为 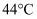 ;月桂酸和
;月桂酸和 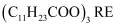 均难溶于水。该工艺条件下,稀土离子保持
均难溶于水。该工艺条件下,稀土离子保持  价不变;
价不变; 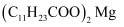 的
的 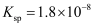 ;
; 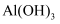 开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
| 离子 | | | | |
| 开始沉淀时的pH | 8.8 | 1.5 | 3.6 | 6.2~7.4 |
| 沉淀完全时的pH | / | 3.2 | 4.7 | / |
-
(1) “氧化调pH”中,化合价有变化的金属离子是。
-
(2) “过滤1”前,用
 溶液调pH至的范围内,该过程中
溶液调pH至的范围内,该过程中  发生反应的离子方程式为。
发生反应的离子方程式为。
-
(3) “过滤2”后,滤饼中检测不到
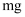 元素,滤液2中
元素,滤液2中  浓度为
浓度为 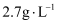 。为尽可能多地提取
。为尽可能多地提取  ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中
,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中  低于
低于  (保留两位有效数字)。
(保留两位有效数字)。
-
(4) ①“加热搅拌”有利于加快
 溶出、提高产率,其原因是。
溶出、提高产率,其原因是。 ②“操作X”的过程为:先,再固液分离。
-
(5) 该工艺中,可再生循环利用的物质有(写化学式)。
-
(6) 稀土元素钇(Y)可用于制备高活性的合金类催化剂
 。
。 ①还原
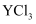 和
和  熔融盐制备
熔融盐制备  时,生成
时,生成 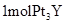 转移
转移  电子。
电子。②
 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化
用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化  的还原,发生的电极反应为。
的还原,发生的电极反应为。
-
(1) 实验室里欲用
 固体来配制240mL0.1mol/L的
固体来配制240mL0.1mol/L的 溶液。
溶液。①需用的仪器托盘天平、药匙、烧杯、玻璃棒、量筒、、。
②实验需要称取
 固体的质量为:g。
固体的质量为:g。③下列操作对实验结果的影响偏大的是。
a.颠倒摇匀后发现凹液面低于刻度线又加水补上
b.未用蒸馏水洗涤烧杯内壁
c.容量瓶内壁附有水珠而未干燥处理
d.加水定容时俯视刻度线
-
(2) 酸性
 溶液与浓盐酸反应的方程式为:
溶液与浓盐酸反应的方程式为: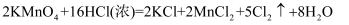
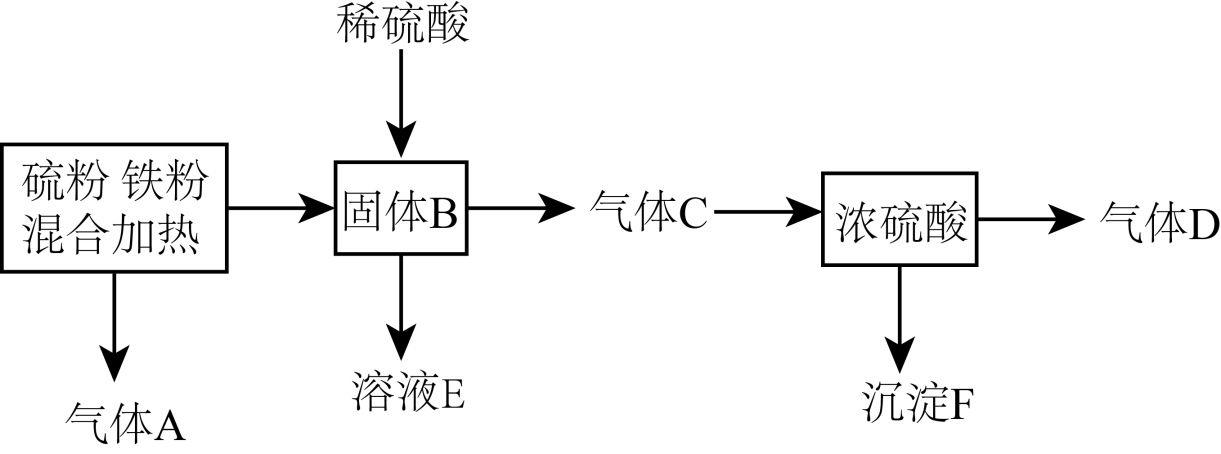
①反应中的氧化剂是,氧化产物是,HCl表现性和性。
②若有73gHCl被氧化,则该反应转移的电子数目为。
③Na与Cl同周期,则Na元素在周期表中的位置为,两元素的最高价氧化物的水化物反应的离子方程式为:。
 2HI(g)的平衡体系加压
2HI(g)的平衡体系加压



