第2章 元素与物质世界 知识点题库
下列实验中,溶液颜色有明显变化的是( )
A . 少量明矾溶液加入到过量NaOH溶液中
B . 往FeCl3溶液中滴入KI溶液,再滴入淀粉溶液
C . 少量Na2O2固体加入到过量NaHCO3溶液中
D . 在酸性高锰酸钾溶液中滴入少量Fe2(SO4)3稀溶液
金属材料在生活生产中应用极其广泛,回答下列问题。
-
(1) 过氧化钠可在呼吸面具或潜水艇中作为氧气的来源,请写出Na2O2的电子式,(填“是”或“不是”)碱性氧化物。
-
(2) 工业上,粗盐需精制,为除去Ca2+需要加入的试剂名称为。食盐中含有KIO3 , 可加入稀硫酸酸化的淀粉碘化钾溶液检测,若变蓝,则说明含有KIO3 , 写出相应反应的离子方程式。等物质的量Cl2、H2O2、ClO2(还原产物为Cl-)消毒效率最高的是。
-
(3) 已知硼酸可治疗湿疹,是一元弱酸,存在电离方程式H3BO3+H2O
 B(OH)
B(OH)  +H+ , 其与过量NaOH反应得到的盐的化学式为。
+H+ , 其与过量NaOH反应得到的盐的化学式为。
-
(4) 含重金属离子Cu2+的废水中,可加入Na2S溶液除去,写出Na2S溶液与Cu2+发生反应的离子方程式;某温度条件下,CuSO4·xH2O失掉0.5个结晶水,失重3.88%,则x=。
下列属于电离方程式且正确的是( )
A . HCO  + OH-= CO
+ OH-= CO  +H2O
B . HCO
+H2O
B . HCO  + H+=CO2↑+ H2O
C . HCO
+ H+=CO2↑+ H2O
C . HCO  + H2O
+ H2O  H2CO3 + OH-
D . HCO
H2CO3 + OH-
D . HCO  + H2O
+ H2O  H3O+ + CO
H3O+ + CO 
 + OH-= CO
+ OH-= CO  +H2O
B . HCO
+H2O
B . HCO  + H+=CO2↑+ H2O
C . HCO
+ H+=CO2↑+ H2O
C . HCO  + H2O
+ H2O  H2CO3 + OH-
D . HCO
H2CO3 + OH-
D . HCO  + H2O
+ H2O  H3O+ + CO
H3O+ + CO 
从海水中提取溴有如下反应: 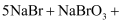
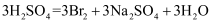 。下列反应中与该反应在氧化还原反应原理上最相似的是( )
。下列反应中与该反应在氧化还原反应原理上最相似的是( )
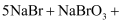
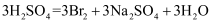 。下列反应中与该反应在氧化还原反应原理上最相似的是( )
。下列反应中与该反应在氧化还原反应原理上最相似的是( )
A . 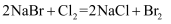 B .
B .  C .
C . 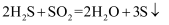 D .
D . 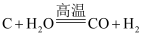
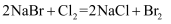 B .
B .  C .
C . 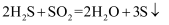 D .
D . 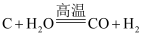
向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法错误的是( )
A . Cu2+将H2O2还原为O2
B . H2O2既表现氧化性又表现还原性
C . Cu2+是H2O2分解反应的催化剂
D . 发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O
下表中对应关系错误的是( )
| A | NaCl=Na++Cl-; NH3·H2O | 均属于电离方程式 |
| B | Ba2++SO HCO | 均可表示一类反应 |
| C | SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
| D | Cl2+2NaOH=NaCl+NaClO+H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
A . A
B . B
C . C
D . D
下表元素周期表的一部分.针对表中的①~⑩种元素,请用化学用语问答下列问题:
|
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
-
(1) 在③~⑦元素中,原子半径最大的是(填元素符号)。
-
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有。
-
(3) 写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:。
-
(4) ③、⑤、⑦、⑨所形成的离子,其半径由小到大的顺序是(填离子符号)。
-
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是(填物质化学式);呈两性的氢氧化物是(填物质化学式),该化合物与NaOH溶液反应的离子方程式为。
-
(6) 写出实验室制取元素⑨的单质的反应的离子方程式:。
钒元素在酸性溶液中有多种存在形式,其中VO2+为蓝色,VO  为淡黄色,VO
为淡黄色,VO  具有较强的氧化性,浓盐酸能把VO
具有较强的氧化性,浓盐酸能把VO  还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
 为淡黄色,VO
为淡黄色,VO  具有较强的氧化性,浓盐酸能把VO
具有较强的氧化性,浓盐酸能把VO  还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
还原为VO2+。向VOSO4溶液中滴加酸性KMnO4溶液,溶液颜色由蓝色变为淡黄色。下列说法正确的是( )
A . 在酸性溶液中氧化性:VO  >
>  >Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO
>Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO  +4H++2Cl-=2VO2++Cl2↑+2H2O
+4H++2Cl-=2VO2++Cl2↑+2H2O
 >
>  >Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO
>Cl2
B . 向酸性(VO2)2SO4溶液中滴加Na2SO3溶液,溶液由淡黄色变为蓝色
C . 向0.1molKMnO4的酸性溶液中滴加1molVOSO4溶液,转移电子为1mol
D . 浓盐酸还原VO2+的离子方程式为2VO  +4H++2Cl-=2VO2++Cl2↑+2H2O
+4H++2Cl-=2VO2++Cl2↑+2H2O
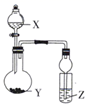
如图所示实验装置,将液体X逐滴加入到固体Y中。下列有关实验现象或结论正确的是( )
| 选项 | X | Y | Z | Z实验现象或结论 | 装置 |
| A | 稀硫酸 | 亚硫酸钠 | 品红溶液 | SO2能氧化品红 | |
| B | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 | |
| C | 浓盐酸 | 石灰石 | 硅酸钠溶液 | 非金属性:C>Si | |
| D | 稀硫酸 | 硫化亚铁 | 硫酸铜溶液 | 无明显现象,弱酸不能制强酸 |
A . A
B . B
C . C
D . D
常温下,下列各组离子因发生氧化还原反应不能大量共存的是( )
A . 在含大量Fe3+溶液中:  、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:
、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:  、Al3+、
、Al3+、  、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、
、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、 
 、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:
、Na+、Cl-、SCN-
B . pH=1的溶液中:Fe3+、K+、I-、Cl-
C . 能与金属铝反应生成氢气的溶液中:  、Al3+、
、Al3+、  、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、
、Cl-
D . 在强碱溶液中:Na+、K+、Cl-、 
下列离子方程式书写正确的是( )
A . 用醋酸除去水垢:CaCO3+2H+ =Ca2++H2O+CO2↑
B . 碳酸钠溶液中加入少量的苯酚:CO  + C6H5OH→C6H5O-+HCO
+ C6H5OH→C6H5O-+HCO  C . 溴乙烷与6 mol·L-1氢氧化钠水溶液共热:C2H5Br+OH-
C . 溴乙烷与6 mol·L-1氢氧化钠水溶液共热:C2H5Br+OH-  CH2=CH2↑+Br-+H2O
D . 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-
CH2=CH2↑+Br-+H2O
D . 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-  HCOO-+NH
HCOO-+NH  +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
 + C6H5OH→C6H5O-+HCO
+ C6H5OH→C6H5O-+HCO  C . 溴乙烷与6 mol·L-1氢氧化钠水溶液共热:C2H5Br+OH-
C . 溴乙烷与6 mol·L-1氢氧化钠水溶液共热:C2H5Br+OH-  CH2=CH2↑+Br-+H2O
D . 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-
CH2=CH2↑+Br-+H2O
D . 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-  HCOO-+NH
HCOO-+NH  +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O
常温时,下列各离子组在指定溶液中能大量共存的是( )
A . 强碱溶液:K+、Na+、AlO  、C2O
、C2O  B . 含S2O
B . 含S2O  的溶液:H+、NH
的溶液:H+、NH  、ClO-、SO
、ClO-、SO  C .
C .  =Kw的溶液:Na+、K+、CO
=Kw的溶液:Na+、K+、CO  、S2-
D . 能与Al反应放出H2的溶液:Na+、Cu2+、NO
、S2-
D . 能与Al反应放出H2的溶液:Na+、Cu2+、NO  、Cl-
、Cl-
 、C2O
、C2O  B . 含S2O
B . 含S2O  的溶液:H+、NH
的溶液:H+、NH  、ClO-、SO
、ClO-、SO  C .
C .  =Kw的溶液:Na+、K+、CO
=Kw的溶液:Na+、K+、CO  、S2-
D . 能与Al反应放出H2的溶液:Na+、Cu2+、NO
、S2-
D . 能与Al反应放出H2的溶液:Na+、Cu2+、NO  、Cl-
、Cl-
某华人科学家和他的团队研发出“纸电池”(如图)。 这种一面镀锌,一面镀二氧化猛的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为,Zn+2MnO2+H2O=ZnO+2MnO(OH)。 下列说法正确的是( )

A . 该电池的正极材料为锌
B . 该电池反应中二氧化锰发生了氧化反应
C . 电池的正极反应式为2MnO2 +2H2O+2e- = 2MnO(OH) +2OH-
D . 当有0. 1mol锌溶解时,流经电解液的电子数为1. 204 × 1023
铅白[2PbCO3·Pb(OH)2]是油画中一种重要的白色颜料,但用铅白作画,日久易变黑(主要成分为PbS),这种现象在书画术语中叫作“返铅”。书画修复中有一种方法是用双氧水清洗使之恢复白色。下列有关叙述正确的是( )
A . 铅白长时间放置于空气中会被氧气氧化
B . 铅白耐强酸耐强碱
C . 用双氧水清洗是利用双氧水的还原性
D . 2PbCO3·Pb(OH)2中铅的质量分数低于PbCO3·Pb(OH)2中铅的质量分数
当光束通过下列分散系时,能观察到丁达尔效应的是( )
A . Fe(OH)3胶体
B . NaCl溶液
C . CuSO4溶液
D . 蔗糖溶液
下列有关铁及其化合物说法错误的是( )
A . 将饱和氯化铁溶液滴入沸水中继续煮沸,可值得氢氧化铁胶体
B . FeCl2既有氧化性又有还原性
C . 铁与硫酸铜溶液反应后滴加KSCN溶液,溶液变红
D . 生铁和钢都是铁的合金,其中生铁的含碳量高于钢
Cl2的制备有电解法和氧化法。完成下列填空:
-
(1) 氯原子的最外层电子排布式为;除稀有气体外,比较与氯元素相邻的短周期元素的原子半径大小。
-
(2) 电解饱和食盐水制Cl2时,为节约电能,可改进装置。向阴极通入O2 , 此时阴极上主要的电极反应式为。
-
(3) 氧化法制Cl2是在CuCl2的催化作用下,O2氧化HCl。写出该反应的化学方程式,标出电子转移的方向和数目。
-
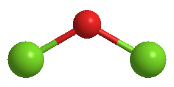
(4) 向饱和氯水中加入适量Ag2O可制HClO溶液,用化学平衡移动原理解释原因。可用Cl2O与水反应来大量生产HClO。Cl2O的球棍模型如图所示,则Cl2O的电子式是,属于分子(选填“极性”或“非极性”)。
下列各组离子因能反应生成气体而不能大量共存的是( )
A .  、
、 、
、 、
、 B .
B .  、
、 、
、 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、 、
、
 、
、 、
、 、
、 B .
B .  、
、 、
、 、
、 C .
C .  、
、 、
、 、
、 D .
D .  、
、 、
、 、
、
2021年5月15日,天问一号着陆巡视器成功着陆火星,探测到火星大气由二氧化碳、氩气(Ar)、水蒸气和甲烷等组成,火星土壤中存在着大量氧化铁,上述物质中属于电解质的是( )
A . 二氧化碳
B . 水
C . 甲烷
D . 氩气
 常用作食盐中的补碘剂,可用“氯酸钾四化法”制备,该方法的第一步反应为
常用作食盐中的补碘剂,可用“氯酸钾四化法”制备,该方法的第一步反应为 3Cl2↑。下列说法正确的是( )
3Cl2↑。下列说法正确的是( )
A .  为还原产物
B . 反应中氧化剂和还原剂的物质的量之比为
为还原产物
B . 反应中氧化剂和还原剂的物质的量之比为 C . 可用澄清石灰水吸收反应产生的
C . 可用澄清石灰水吸收反应产生的 制备漂白粉
D . 产生
制备漂白粉
D . 产生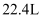 (标准状况)
(标准状况) 时,转移
时,转移

 为还原产物
B . 反应中氧化剂和还原剂的物质的量之比为
为还原产物
B . 反应中氧化剂和还原剂的物质的量之比为 C . 可用澄清石灰水吸收反应产生的
C . 可用澄清石灰水吸收反应产生的 制备漂白粉
D . 产生
制备漂白粉
D . 产生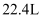 (标准状况)
(标准状况) 时,转移
时,转移

最近更新
 NH
NH