第4章 材料家族中的元素 知识点题库
①加入氯水 ②加入KMnO4溶液 ③加入NH4SCN溶液.
(一)探究铝合金的抗腐蚀性能
①向一只小烧杯里加入20mL0.5mol/LCuSO4溶液,把一小块铝合金浸入溶液中,1~2分钟后将铝片取出,观察铝片表面的现象
②取1只试管,加入10mL2mol/LNaOH溶液,将一块铝片放入NaOH溶液里,片刻取出后,用蒸馏水冲洗后浸入CuSO4溶液里.1~2分钟后将铝片取出,观察铝片表面的现象
实验①铝片没有变化,实验②铝片表面的现象是
发生此现象的原因是
(二)测定铝合金中的铝的百分含量
①取该样品a克,将样品溶于足量的稀盐酸中,过滤;
②在滤液中加入过量的氢氧化钠溶液,过滤;
③往第②步的滤液中通入足量的CO2 , 过滤,将沉淀用蒸馏水洗涤后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为b克.
回答下列问题:
(1)在第①步操作中溶解所使用的玻璃仪器为玻璃棒、 ,滤液中主要含有Mg2+、Na+、 和Cl﹣离子;
(2)在第②步操作中氢氧化钠溶液需要过量的原因是 ,写出该步骤中生成沉淀的离子方程式
(3)第③步灼烧过程中可在下列哪种仪器中进行
A.烧杯 B.试管 C.坩埚 D.蒸发皿
(4)第③步灼烧后得到的固体是
(5)合金中铝的质量分数是 .
-
(1) 铝的原子结构示意图为.它位于元素周期表的第周期,第族.
-
(2) 实验室制备氢氧化铝的常用方法是在氯化铝溶液中滴加氨水,反应的离子方程式为.
-
(3) 常温下,铁跟水不反应,但红热的铁会跟水蒸气发生反应,反应的化学方程式为.
-
(4) 检验某溶液中是否含有Fe3+的操作方法是.
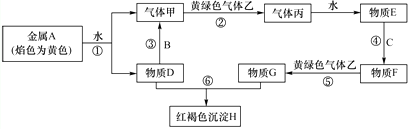
请根据以上信息回答下列问题:
-
(1) 写出下列物质的化学式:乙、H.
-
(2) 写出反应⑤的离子方程式:.
-
(3) D溶液与F溶液反应,生成沉淀,该沉淀的化学式为,该沉淀在空气中由白色很快变为灰绿色最后变为红褐色,该反应的化学方程式为.
-
(4) 物质C与物质E的溶液反应生成5.6L氢气(标准状况)时,参与反应的物质C的质量是克.
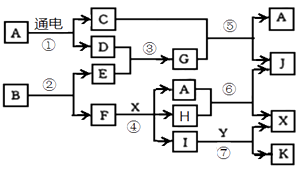
请按要求填空:
-
(1) B和G含有的共同元素在周期表中的位置是。
-
(2) 过量气体G与氯气反应可以生成一种单质和一种盐,该盐的电子式为 。
-
(3) 写出反应④的离子方程式,并用单线桥标出电子转移情况。
-
(4) 反应⑤的化学方程式为。
-
(1) 材料是人类赖以生存和发展的重要物质基础。
①水泥是最常用的建筑材料,它属于(填字母)。
a. 金属材料 b. 无机非金属材料 c. 有机高分子材料
②下列硅酸盐产品的生产原料中不需要石灰石的是(填字母)。
a. 陶瓷 b. 水泥 c. 玻璃
③高岭土是烧制瓷器的重要原料,其组成可以表示为Al2Si2Ox(OH)y , 其中x , y的数值分别是(填字母)。
a. 5、4 b. 6、3 c. 7、2
④下列物品的构成材料中主要是合成高分子材料的是(填字母)。
a. 宣纸 b. 羊毛衫 c. 保鲜膜
⑤橡胶是制造轮胎的主要原料,天然橡胶是结构(填“线型”或“体型”),需经过硫化处理改变其结构,增强其机械强度。
-
(2) 某品牌果冻标签如图所示。回答下列问题:

①食品添加剂中,属于无机盐的是(填化学式)。
②属于着色剂的是诱惑红和;属于防腐剂的是。
③配料表中白砂糖的成分是蔗糖,请写出蔗糖在人体内水解的化学方程式。
-
(3) 化学与科学技术、生产生活及环境保护等密切相关。
①2016年12月我省启动了保卫碧水蓝天的“263”行动,减少煤炭消费总量,减少雾霾天气的发生。形成硫酸型酸雨的主要气体是;严格整治畜禽养殖场污染 , 主要是为减少和P等元素及化学需氧量对水体的污染。
②目前正在推广用尿素水解液来消除柴油汽车尾气中的氮氧化物。写出尿素水解液中的NH3与NO在催化剂作用下,反应生成无污染物质的化学方程式。
③阿司匹林作为一种药物,主要具有作用;Mg2Si3O8·nH2O(三硅酸镁)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2 ·H2O等物质的化学方程式。
-
(1) 原溶液中c(SO42-)=;
-
(2) 原溶液中H2SO4和Fe2(SO4)3的物质的量浓度之比为。
-
(1) I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
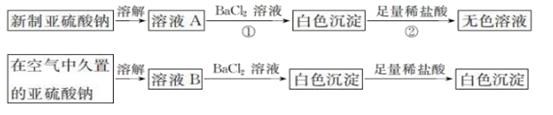
写出上述实验中②的离子方程式:。
-
(2) 通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有__(填化学式)。
-
(3) 亚硫酸钠晶体样品若变质,下列说法错误的是 。A . 晶体表面变黄 B . 其水溶液pH将减小 C . 其样品质量将增加
-
(4) II.以FeCl3 溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
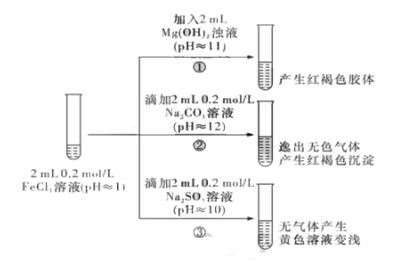
①中反应的离子方程式是._。
-
(5) ②中逸出的无色气体是_(写化学式)。
-
(6) 对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液, 产生白色沉淀。得出结论:
FeCl3与Na2SO3 发生了氧化还原反应,离子方程式是_。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_。
 在空气中放置一段时间,由淡黄色变为白色:
在空气中放置一段时间,由淡黄色变为白色:  B . “以曾青涂铁,铁赤色如铜”:
B . “以曾青涂铁,铁赤色如铜”: 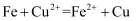 C .
C . 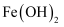 在空气中迅速变成灰绿色最后变成红褐色:
在空气中迅速变成灰绿色最后变成红褐色: 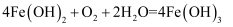 D . 向
D . 向 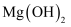 悬浊液中滴加足量
悬浊液中滴加足量  溶液,出现红褐色沉淀:
溶液,出现红褐色沉淀: 
 B .
B .  C .
C .  D .
D . 
 , 是一种无机高分子铝的聚合物,已广泛用于生活废水处理。由偏铝酸钙[
, 是一种无机高分子铝的聚合物,已广泛用于生活废水处理。由偏铝酸钙[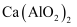 ]制备聚合氯化铝的一种工艺流程如下:
]制备聚合氯化铝的一种工艺流程如下:
-
(1) “偏铝酸钙可由水硬铝石[AlO(OH)]与石灰石在高温下煅烧得到,写出该反应的化学方程式:。
-
(2) 常温下,经测定“破浸”后溶液的pH=12,要使“沉淀Ⅰ”中不含有
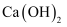 , 则溶液中的c(CO
, 则溶液中的c(CO )≥mol/L。{25℃时
)≥mol/L。{25℃时 ,
,  }
}
-
(3) “沉降”时,发生反应的离子方程式为。
-
(4) 过滤后,“洗涤”
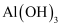 沉淀的操作是。
沉淀的操作是。
-
(5) 若要使聚合氯化铝
 中a=2,则实验过程中需要控制条件除温度外,还要控制条件是。
中a=2,则实验过程中需要控制条件除温度外,还要控制条件是。
-
(6) 上述“碱浸”过程中,在相同条件下,使用相同浓度的
 溶液比NaOH溶液浸出率高的原因是。
溶液比NaOH溶液浸出率高的原因是。



