第4章 材料家族中的元素 知识点题库
 B .
B .  C .
C .  D .
D . 
-
(1) B:、E:
-
(2) ①C加热分解的化学方程式:
②A与无色无味气体反应的离子方程式:
③由白色沉淀最终变为红褐色沉淀E的化学方程式:.
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1mol/L乙溶液中c(H+)>0.1mol/L;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成.
下列结论不正确的是( )

-
(1) 铜元素在周期表中的位置是;铜离子的价电子排布图是;
-
(2) Cu2+能与NH3、H2O、Cl﹣等形成配位数为4的配合物,[Cu(NH3)4]2+具有对称的空间构型,其结构简式(必须将配位键表示出来)是;名称是;[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为;
-
(3) 根据价层电子对互斥模型,预测SO42一的空间构型为,与SO42﹣属于等电子体的离子有;(试写两例)
-
(4) 铜与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2中含有π键的数目为,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是.

-
(1) 硫酸的物质的量浓度是多少?
-
(2) 若a=10,矿石样品中Fe2O3的质量是多少?
-
(3) 试计算a的取值范围.
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
C | 向铁和稀硝酸反应后的漭液中若滴加KSCN溶液显红色:若滴加酸性高锰酸钾溶液紫红色褪去 | 该溶液中既有Fe3+ , 还有Fe2+ |
D | 浓硫酸有脱水性 | 浓硫酸可用于干燥H2和CO |
-
(1) I.碳酸亚铁的制备(装置如下图所示)
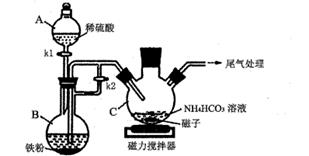
仪器B的名称是;实验操作如下:打开kl、k2 , 加入适量稀硫酸,关闭kl , 使反应进行一段时间,其目的是。
-
(2) 接下来要使仪器C中的制备反应发生,需要进行的操作是,其反应的离子方程式为。
-
(3) 仪器C中混合物经过滤、洗涤得到FeCO3沉淀,检验其是否洗净的方法是。
-
(4) Ⅱ.乳酸亚铁的制各及铁元素含量测定
向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
-
(5) 两位同学分别用不同的方案进行铁元素含量测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于l00%,其原因可能是 。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24. 80 mL,则样品纯度为%(保留1位小数)。
-
(1) 制备K2FeO4(夹持装置略)
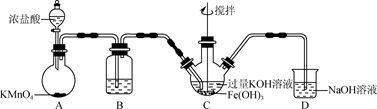
①装置B中所用试剂为。
②C中得到紫色固体和溶液,C中发生的主要反应为(用化学方程式表示)。
-
(2) 探究K2FeO4的性质
①将K2FeO4溶液滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明酸性条件下
 与
与  氧化性的强弱关系,请说明理由:。
氧化性的强弱关系,请说明理由:。②取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2 , 某同学设计了以下方案:取少量a,滴加KSCN溶液至过量,溶液呈红色。该方案并不完善,因为溶液变红的原因可能是,(用离子方程式表示),重新设计实验方案,证明是K2FeO4氧化了Cl-而产生Cl2:将装置C中混合物过滤,。[实验中必须使用的试剂:盐酸、KOH溶液、淀粉碘化钾试纸]
 制品
D . 飞天航天服壳体使用铝合金材料,具有质轻、熔点比纯铝高的优点
制品
D . 飞天航天服壳体使用铝合金材料,具有质轻、熔点比纯铝高的优点
 、
、 、
、 的过程可表示为:
的过程可表示为:

-
(1) “酸浸”时,三价镍、三价钴、四价锰转化为
 、
、 、
、 进入溶液。该过程中
进入溶液。该过程中 的作用是。保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率如图所示。60℃时浸出率达到最大,可能的原因是。
的作用是。保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率如图所示。60℃时浸出率达到最大,可能的原因是。
-
(2) “除铁”生成黄钠铁矾沉淀时需控制溶液的
 为15~18.该过程中需不断加入
为15~18.该过程中需不断加入 溶液,其作用是。
溶液,其作用是。
-
(3) 物质X可调节溶液的
 , X为____(填序号)
A .
, X为____(填序号)
A . B .
B .  C .
C . 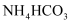
-
(4) 回收液可用于合成锂离子电池正极材料,合成前需测定其中
 等离子的浓度。
等离子的浓度。测定原理:用过量标准
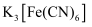 溶液氧化经预处理的回收液样品中的
溶液氧化经预处理的回收液样品中的 , 再用标准
, 再用标准 溶液滴定过量的
溶液滴定过量的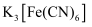 。
。反应方程式为:
 。
。测定过程:取预处理后的回收液样品
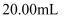 , 向其中加入
, 向其中加入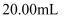

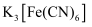 溶液,充分反应;再用
溶液,充分反应;再用
 溶液滴定反应后的溶液,消耗
溶液滴定反应后的溶液,消耗 溶液
溶液 。
。数据分析:计算预处理后的回收液样品中
 的物质的量浓度。(写出计算过程)
的物质的量浓度。(写出计算过程)



