第4章 材料家族中的元素 知识点题库
下列关于工业生产的叙述中,错误的是( )
A . 制普通玻璃的主要原料是纯碱、石灰石、石英
B . 氨是制作氮肥、硝酸、铵盐的重要原料
C . 将氢气和氯气混合光照生成氯化氢,溶于水制得盐酸
D . 制造普通水泥的主要原料是黏土、石灰石
下列有关非金属单质的说法正确的是( )
①硅单质可用来制造太阳能电池
②氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气
③硫、氯气分别与铜和铁反应的产物是FeS、Cu2S、FeCl3、CuCl2
④向氢硫酸溶液中滴入氯水有单质硫生成
⑤为防止NaOH溶液变质,常将其保存在磨口玻璃瓶中
⑥活性炭使有色物质褪色是利用了碳单质具有还原性,使有色物质发生还原反应
⑦雷雨天氮气和氧气的反应属于自然固氮的一种方式.
A . ①②③⑤⑥
B . ②③⑥⑦
C . ①②③④⑦
D . ①②④⑥
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).


请回答下列问题:
-
(1) 若A为第三周期的金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,F的浓溶液与A、D反应都有红棕气体生成,则A的原子结构示意图为;反应④的化学方程式为:.
-
(2) 若A为用量最大的金属,D、F是气态单质,反应②的离子方程式是:,A与水蒸气反应的化学方程式为:.
-
(3) 若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,B常用作光导纤维,A、F所含元素同周期,则E的电子式为,反应①的化学方程式为.
根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%.
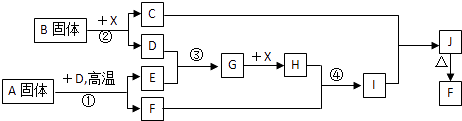
-
(1) A的化学式为; F的化学式为;
-
(2) 反应③的化学方程式:;
-
(3) 反应②的离子方程式:;
-
(4) 反应④的离子方程式:;
-
(5) 已知每生成16g E,放出106.5kJ热量,则反应①的热化学方程式为:.
下列叙述不正确的是( )
A . Na失火不能用CO2灭火,K失火也不能用CO2灭火
B . Al与S直接化合可以得到Al2S3 , Fe与S直接化合则得不到Fe2S3
C . 将SO2通入BaCl2溶液中没有白色沉淀生成,将SO2通入Ba(NO3)2溶液中也没有白色沉淀生成
D . CuSO4•5H2O投入浓H2SO4中,固体颜色由蓝变白
某溶液中只可能含有下列离子中的几种:Na+、NH4+、SO42﹣、CO32﹣、NO3﹣、Cl﹣(不考虑溶液中少量的H+和OH﹣),取200mL该溶液,分为两等份进行下列实验:
①第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL;
②第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g.
③在②的滤液中滴入AgNO3 , 产生白色沉淀,加稀硝酸,沉淀不溶解.
下列说法正确的是( )
A . 该溶液中可能含Na+
B . 该溶液中肯定含有NH4+、SO42﹣、Cl﹣
C . 该溶液中一定不含NO3﹣、CO3﹣
D . 该溶液中一定含有Na+
同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
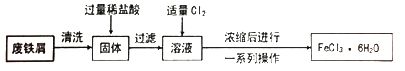
请回答下列问题。
-
(1) 固体中加入过量稀盐酸时的现象是。
-
(2) 溶液中通入Cl2时发生反应的化学方程式是,反应中Cl2表现出的性质是,此处的Cl2也可以用代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
-
(3) 上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括、过滤、洗涤。
-
(4) 用FeCl3溶液制备Fe2O3 , 可向FeCl3溶液中滴加足量,然后过滤、洗涤、,即可得到Fe2O3。
-
(5) FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是,反应一段时间后,取少量腐蚀液,向其中滴加,观察到,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是。
下列说法正确的是( )
A . 可用品红溶液检验SO2
B . 常温下,可用铝罐贮运稀硝酸
C . NaOH溶液可长期贮存在带玻璃塞的试剂瓶中
D . 常温常压下,22.4LN2含有氮原子数为2×6.02×1023
某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:

-
(1) A装置的作用是,烧瓶底部放碎瓷片的作用是。
-
(2) 装置B中发生反应的化学方程式是,该反应中氧化剂是,氧化产物是。
-
(3) D的作用是。
-
(4) E中的实验现象是。
-
(5) A、B两个装置中应先点燃处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是。
-
(6) 该同学对反应后硬质试管中固体物质的组成提出了如下假设:
假设1:只有Fe;
假设2:只有;
假设3:既有Fe也有Fe3O4。
在热的稀硫酸中溶解了7.6gFeSO4固体,当加入50mL0.5mol·L-1KNO2溶液时,其中的Fe2+全部转化成Fe3+ , KNO2也完全反应并放出NxOy气体。
-
(1) 配平FeSO4+KNO2+ H2SO4 = K2SO4+ Fe2(SO4)3+ □↑+H2O。
a.请填好方程式中的系数。
b.□中物质的化学式为。
-
(2) 检验反应后溶液中的Fe3+的具体操作方法为。
-
(3) 标准状况下,当生成NxOy气体的体积为2.24L时,转移的电子数目为。
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A . NaHCO3(s)  Na2CO3(s)
Na2CO3(s)  NaOH(aq)
B . Al(s)
NaOH(aq)
B . Al(s)  NaAlO2(aq)
NaAlO2(aq)  Al(OH)3(s)
C . AgNO3(aq)
Al(OH)3(s)
C . AgNO3(aq)  [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)  Ag(s)
D . Fe2O3(s)
Ag(s)
D . Fe2O3(s) 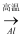 Fe(s)
Fe(s)  FeCl3(aq)
FeCl3(aq)
 Na2CO3(s)
Na2CO3(s)  NaOH(aq)
B . Al(s)
NaOH(aq)
B . Al(s)  NaAlO2(aq)
NaAlO2(aq)  Al(OH)3(s)
C . AgNO3(aq)
Al(OH)3(s)
C . AgNO3(aq)  [Ag(NH3)2]+(aq)
[Ag(NH3)2]+(aq)  Ag(s)
D . Fe2O3(s)
Ag(s)
D . Fe2O3(s) 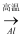 Fe(s)
Fe(s)  FeCl3(aq)
FeCl3(aq)
昆仑玉的成分可简单看作Ca2Mg5Si8O22(OH)2 , 则用氧化物的形式可表示为( )
A . CaO·MgO·SiO2·H2O
B . 2CaO·5MgO·8SiO2·H2O
C . 2CaO·MgO·SiO2·H2O
D . 5CaO·2MgO·8SiO2·H2O
工业上用铝土矿(主要成分是 Al2O3 , 还含有 Fe2O3、SiO2)提取氧化铝做冶 炼铝的原料(纯净的 Al2O3),某研究性学习小组设计了如下提取流程:

请回答下列问题:
-
(1) 操作①的名称是,操作③用到的仪器有酒精灯、三脚架、泥三角。
-
(2) 固体②的颜色为。
-
(3) 流程④中生成 Al(OH)3 的离子方程式是。
-
(4) 上述流程不涉及的化学反应类型是___________。A . 复分解反应 B . 氧化还原反应 C . 化合反应 D . 分解反应
-
(5) 用固体①制备硅酸,涉及的化学反应方程式为、。
-
(6) 有一种含铁、硅等元素的矿石,其主要成分的化学式为 Na2Fe5(OH)2Si8O22 , 该物质中+2 价铁与+3 价铁的物质的量之比为。将mg该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为 Fe2+ , 过滤后滤液用 c mol/L 的 KMnO4 酸性溶液与Fe2+反应,用去VmL溶液。该矿石中铁元素的质量分数为(用含 m、c、V 的代数式表示)。
下列物质之间的转化都一步能实现的是( )
A . S→SO3→H2SO4→SO2→Na2SO3→Na2SO4
B . Si→SiO2→H2SiO3→Na2SiO3
C . Al→Al2O3→Al(OH)3→NaAlO2
D . Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3
材料与生产、生活密切相关。下列说法错误的是( )
A . 高纯硅可用作太阳能电池板材料
B . 新版人民币油墨中含有的Fe3O4具有磁性
C . 口罩中熔喷布的主要材料聚丙烯是纯净物
D . 天眼反射镜中使用的金刚砂属于新型无机非金属材料
某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体的装置(省略夹持装置,气密性已检查)如图所示。下列推断不合理的是( )

A . 烧杯中H2O2溶液的作用是将Fe2+氧化为Fe3+
B . A中存在氧化铁与盐酸生成氯化铁的反应
C . B中收集到的气体是氢气
D . 将反应后的溶液放入烧杯中再通入少量SO2 , 则溶液颜色立即由棕黄色变为浅绿色
钢铁是现代工业的脊梁我国钢铁产量多年位居世界第一。现有一块铁碳合金(钢铁材料),某化学兴趣小组为了测定合金中铁的质量分数,并探究浓硫酸的某些性质设计了如图所示的实验装置进行实验(夹持仪器已省略),请你参与其中:

-
(1) 仪器A的名称是 。按图示连接好装置,先,再加入药品,称量F的质量。
-
(2) 将mg合金样品放入A中,再加入适量的浓硫酸,未点燃酒精灯前,A、B中均无明显现象,原因是。
-
(3) 点燃酒精灯一段时间后,A、B中可观察到明显的现象。A中发生反应的化学方程式为
 、。B中的现象为。
、。B中的现象为。
-
(4) 装置C的作用是 。
-
(5) D中盛放的试剂是。
-
(6) 反应一段时间待A中不再逸出气体时,停止加热恢复到室温后拆下F称重F增重bg。则铁碳合金中铁的质量分数为 (用含m、b的代数式表示)。
-
(7) 最后对所得测定结果进行评价时,小组内有同学提出本套装置在设计上存在缺陷而导致铁质量分数测定值偏低,可能的原因是 。
利用“价类二维图”研究物质的性质,是一种有效的学习方法。如图是铁元素及其化合物的二维图的部分信息。

-
(1) X的化学式为,图中只具有还原性的物质是 (写化学式)。
-
(2) 实验室制备Fe(OH)2时,常伴随着反应②发生,此时的实验现象是。
-
(3) 写出反应③的化学方程式。
-
(4) 为探究Fe(NO3)2晶体的热分解产物。某化学兴趣小组按图进行了如图实验,回答下列问题:

①实验时观察到A处试管中有红棕色气体生成,说明硝酸亚铁晶体分解产物含有,B中无水硫酸铜变蓝,说明分解产物中含有。
②检验热分解后的固体为氧化铁的方案为
实验步骤
现象
(i)取反应后少量红棕色固体于试管中,加入稀硫酸溶解
溶解后得色溶液
(i)向少许(i)溶液中滴入少量
溶液变成红色
由以上实验结果写出Fe(NO3)2·xH2O分解的化学方程式。
下列物质转化能通过一步反应实现的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
长征五号系列运载火箭是我国首型大推力无毒、无污染液体燃料火箭,运载能力位居世界前列,是中国由航天大国迈向航天强国的显著标志和重要支撑。下列叙述错误的是( )
A . 火箭芯一级尾段使用的碳纤维材料属于新型无机非金属材料
B . 火箭的整流罩前锥段材料-聚甲基丙烯酰亚胺属于有机高分子材料
C . 火箭采用2219-铝合金做箭体的蒙皮材料,有利于减轻火箭的质量
D . 火箭的推进剂是四氧化二氮和偏二甲肼
最近更新



