第4章 材料家族中的元素 知识点题库
将一定质量的镁铝合金样品全部溶于100mL某浓度的盐酸中.向所得溶液中滴加5.0mol/L的NaOH溶液,生成沉淀质量与加入的NaOH溶液体积关系如图所示.
(1)19.4g沉淀中含有Al(OH)3的质量为 ;
(2)盐酸的物质的量浓度为 .

-
(1) 若Y是黄绿色气体,则Y的电子式是,该反应的离子方程式是.
-
(2) 若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是.
-
(3) 若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中.
①A元素在周期表中的位置是(填所在周期和族);Y的化学式是.
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是
mol.
-
(4) 若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是.
实验1 |
| 实验现象 |
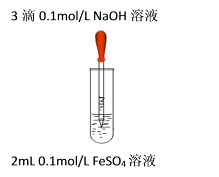
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
-
(1) 实验1中产生白色沉淀的离子方程式是。
-
(2) 为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
① 甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3 , 方案是。
② 乙同学查阅文献:Fe(OH)2在大量SO42存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入,再往试管中加入,振荡,现象与实验1相同,结论是该假设不成立。
③ 乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10 mL
NaOH溶液
滴加
FeSO4溶液
实验现象
实验2
6 mol/L
NaOH溶液
0.2mol/L FeSO4溶液
产生悬浮于液面的白色沉淀(带有少量灰绿色) ,沉淀下沉后,大部分灰绿色变为白色沉淀
实验3
6 mol/L
NaOH溶液
0.1mol/L FeSO4溶液
产生悬浮于液面的白色沉淀(带有极少量灰绿色) ,沉淀下沉后,底部都为白色沉淀
该实验得出的结论是,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是,证明该假设成立。
-
(3) 丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为。
-
(4) 根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件。
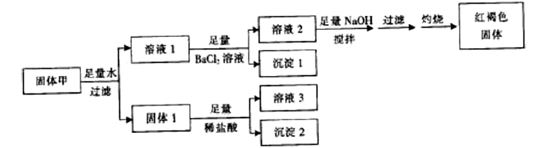
固体1质量为11g,沉淀1质量为23.3g,沉淀2质量为6g,红褐色固体质量为8g。下列说法正确的是( )
-
(1) NaOH溶液的物质的量浓度为mol·L-1。
-
(2) 沉淀的质量达到最大时为g(用含w的表达式表示)。
-
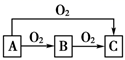
(1) 若A是一种金属,C是淡黄色固体,则B的化学式为,A→C反应的化学方程式为。
-
(2) C可用于呼吸面具或潜水艇中氧气的来源,写出所发生的化学方程式从氧化剂和还原剂的角度分析,在这个反应中C的作用是 。
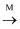 Y
Y 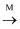 Z(每步只发生一个反应)所示转化的是( )
Z(每步只发生一个反应)所示转化的是( ) | 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | C | CO | CO2 | O2 |
| C | CO2 | Na2CO3 | NaHCO3 | NaOH |
| D | | Al(OH)3 | Al3+ | CO2 |
 试纸中央,试纸变红后不褪色
B . 向
试纸中央,试纸变红后不褪色
B . 向 固体中加入适量水,再滴加几滴酚酞,溶液变红后不褪色
C . 向
固体中加入适量水,再滴加几滴酚酞,溶液变红后不褪色
C . 向 溶液中加入
溶液中加入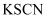 溶液,不变红,滴加少量氯水后溶液变红
D . 向碘的饱和水溶液中加入适量
溶液,不变红,滴加少量氯水后溶液变红
D . 向碘的饱和水溶液中加入适量 , 溶液分层,上层显紫红色
, 溶液分层,上层显紫红色