2.2 海水中的氯 知识点题库
-
(1) 硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2 , 会出现软而透明的凝胶胶体,其离子方程式是;
-
(2) 实验室通常用MnO2与浓盐酸反应制取氯气,其反应的离子方程式是;实验室通常用铵盐和消石灰制取氨气,其反应的化学方程式是;红热的木炭能与浓硝酸反应,写出反应的化学方程式;
-
(3) 铝和氢氧化钡溶液反应生成偏铝酸钡,反应的化学方程式为;
-
(4) 氢氧化亚铁被空气里氧气氧化,反应的化学方程式为.

-
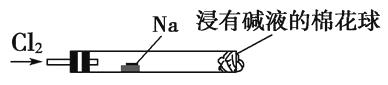
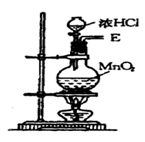
(1) 实验室常用装置E制备Cl2 , 写出该反应的离子方程式:.
-
(2) 反应开始后,发现B、D两个容器中的品红溶液都褪色,停止通气后,加热B、D两个容器,现象分别为B;D.
-
(3) 装置C的作用是.
-
(4) 该实验小组的甲、乙两位同学利用上述两套发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅.
试根据该实验装置和两名同学的实验结果回答问题.
①试分析甲同学实验过程中,品红溶液不褪色的原因是(用离子方程式进行说明)
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?.
-
(1) 氯原子的原子结构示意图;氯离子的电子式.
-
(2) 氯气能使湿润的有色布条褪色,起到漂白作用的物质是(写名称).漂粉精的主要有效成分是(写化学式).
-
(3) 实验室制取氯化氢的化学方程式;
-
(4) 工业上将含有氯气的尾气通过进行处理,在处理时发生的反应中氯气作为.
a.氧化剂 b.还原剂 c.既是氧化剂又是还原剂 d.既不是氧化剂又不是还原剂
-
(5) 写出氯气的两种用途,.
[制备CuCl2·2H2O晶体]
-
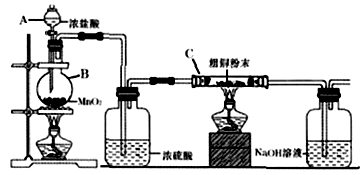
(1) 仪器B的名称是;B中反应的离子方程式为。
-
(2) 装置C中粗铜粉末与气体充分反应时的生成物是(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用(填符合题意答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:。
-
(3) [制备CuCl 固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2 , 再加热到300℃以上可获得CuCl固体。
将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是。 -
(4) 为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固体平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理: CuCl+ FeCl3=CuCl2+FeCl2 , Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为。
(1) 书写电离方程式:KClO3:________;H2SO4:________
-
(1) 书写电离方程式:KClO3:;H2SO4:
-
(2) 某金属氯化物 MCl2 40.5g 中含有 0.6mol Cl,则 MCl 2 的摩尔质量为
-
(3) 工业上用电解饱和食盐水制 Cl2 , 写出该反应的化学方程式:
-
(4) 工厂里常用浓氨水来检验氯气管道是否泄漏,其原理为:8NH3+3Cl2=6NH4Cl+N2 , 请用双线桥表示其电子转移的方向和数目
-
(5) 相同温度和体积的 A 和 B 两容器,A 容器中充满 O2 , B 容器中充满 O3 , 若密度相同,则氧气和臭氧的物质的量之比为:.
-
(1) 实验室制氯气的化学方程式:,此反应的氧化剂为: ;还原剂为:;氧化剂与还原剂物质的量之比为:;
-
(2) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式,并画出双线桥,标出电子转移的方向和数目:。
-
(3) 漂白粉的有效成分是(填化学式)。
-
(1) 25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三 者中所占分数(α)随pH变化的关系如图1所示:
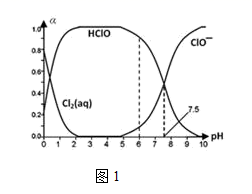
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是。
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为。
-
(2) ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2 , 写出该反应 的化学方程式。
-
(3) 工业上还可用下列方法制备ClO2 , 在80℃时电解氯化钠溶液得到NaClO3 , 然后与盐酸反应得到ClO2 . 电解时,NaClO3在极(填阴或阳)生成,生成
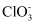 的电极反应式为。
的电极反应式为。
-
(4) 一定条件下,在水溶液中 1mol Cl-、1mol
 (x=1,2,3,4)的能量大小与化合价的关系如图2所示:
(x=1,2,3,4)的能量大小与化合价的关系如图2所示: 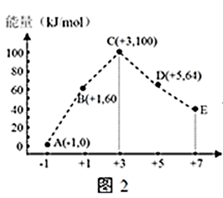
①从能量角度看,C、D、E中最不稳定的离子是(填离子符号)。
②B→A+D反应的热化学方程式为(用离子符号表示)。

-
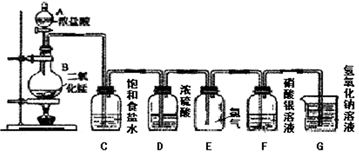
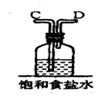
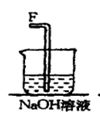
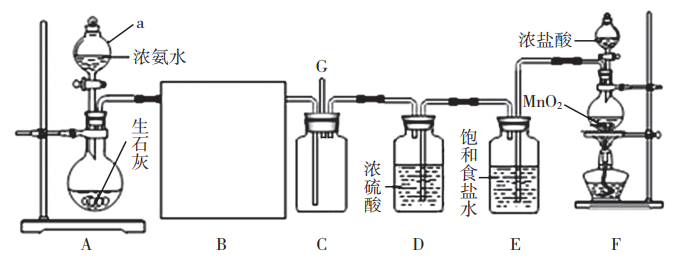
(1) 该反应中生成氯气的化学方程式为:。
-
(2) 连接上述仪器的正确顺序是:(填各接口处的字母)E接接,接接,接__。。
-
(3) 在装置中,①饱和食盐水起的作用是 。
②浓硫酸起的作用是。
③NaOH溶液的作用是。
-
(4) 写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式:。
-
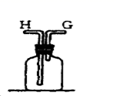
(1) 仪器a的名称是。
-
(2) 检查装置A气密性的方法是。
-
(3) 用装置A制取氨气的化学方程式为。
-
(4) 请为B处框内选择合适的装置及相应的试剂____(选填字母)。A . 球形干燥管装碱石灰 B . 洗气瓶装浓硫酸 C . 球形干燥管装氧化钙 D . 球形干燥管装

-
(5) 装置E的作用是,装置D和E的位置(选填“能”或“不能”)调换。
-
(6) 实验中可观察到装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出此反应的化学方程式:,若有1mol
 被氧化,则转移的电子数目为。
被氧化,则转移的电子数目为。
 B .
B .  C .
C .  D .
D . 
-
(1) Ⅰ.现有以下物质:①
 ②Fe ③
②Fe ③ ④
④ 胶体 ⑤
胶体 ⑤ 溶液 ⑥干冰⑦稀硫酸 ⑧酒精 ⑨
溶液 ⑥干冰⑦稀硫酸 ⑧酒精 ⑨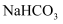 ⑩氯水
⑩氯水以上物质中属于非电解质的是(填序号)。
-
(2) 请写出③的电子式。
-
(3) 写出⑤中溶质的电离方程式。
-
(4) 以上物质中,有一种能在一定条件下与
 反应,且
反应,且 做氧化剂,请写出该反应的化学方程式:。
做氧化剂,请写出该反应的化学方程式:。
-
(5) 向④中逐滴滴加⑦,可观察到的现象是。
-
(6) Ⅱ.氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空。(a、b、c、d中重合部分代表物质间反应,且氯水足量)
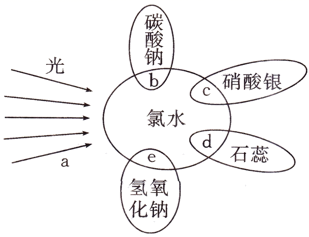
能证明氯水具有漂白性的是 (填“a”、“b”、“c”、“d”)
-
(7) 氯水久置过程中发生的变化,用化学反应方程式表示为。



