2.2 海水中的氯 知识点题库
下列有关气体摩尔体积的说法中正确的是( )
A . 在常温常压下,0.5 mol任何气体的体积都必定是11.2 L
B . 在标准状况下,1 mol任何物质的体积都约是22.4 L
C . 常温常压下,1 mol任何气体的体积都约是22.4 L
D . 在标准状况下,0.5 mol CO2所占有的体积约是11.2 L
实验室用MnO2粉末与浓盐酸共热制取氯气:MnO2+4HCl  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
 MnCl2+Cl2↑+2H2O
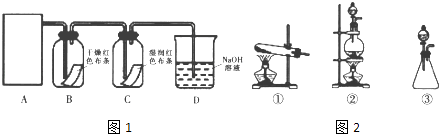
MnCl2+Cl2↑+2H2O 实验Ι 验证氯气能否与水反应,某同学设计了如图1所示的实验装置:
-
(1) 从如图2选择适合A处的装置(填序号).
-
(2) 装置B中能否观察到预期的实验现象?(填“能”或“不能”),请说明理由.
-
(3) 实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol∙L﹣1的NaOH溶液,配制过程如下:
①称量gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却.
②将烧杯中的溶液转移至中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中.
③继续加蒸馏水至刻度线1~2cm处,改用滴加蒸馏水至凹槽面最低处与刻度线相切.
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签.
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL.
完成步骤一的空格.
-
(4) 根据实验数据,计算反应后A中残余盐酸的浓度为mol•L﹣1 .
-
(5) 某同学欲通过测Cl﹣浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,价2.00mol•L﹣1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是.
氯元素在自然界的主要存在形式是( )
A . Cl2
B . HCl
C . NaCl
D . KClO3
下列叙述中,正确的是( )
A . 铜和FeCl3溶液均能导电,但二者都不是电解质
B . 分解反应的生成物中一定有单质
C . 分散质粒子的直径在1×10﹣9~1×10﹣7cm之间的分散系属于胶体
D . 氯气不能使干燥的有色布条褪色,液氯能使干燥的有色布条褪色
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:

-
(1) C、G两个装置所盛放的试剂分别是: CG.
-
(2) ①装置搭好须进行气密性检查,写出操作方法:.
②两处酒精灯应先点燃处(填写A或B),目的是.
③F中的现象为,G中出现了一种沉淀,该沉淀的化学式.
-
(3) 写出在A、E中发生反应的化学方程式为:
A:.
E:.
一定条件下,一种反应物过量,另一种反应物可以完全反应的是( )
A . 过量的水与氯气
B . 过量的氢氧化钠与二氧化硅
C . 过量的二氧化锰与浓盐酸
D . 过量的氨水与氢氧化铝
用 NA 表示阿伏加德罗常数,下列叙述正确的是( )
A . 标准状况下,22.4 L H2O 的物质的量为 1mol
B . 常温常压下,106 g Na2CO3 含有的 Na+离子数为 2NA
C . 室温下,1NA个 CO2 分子占有的体积为 22.4 L
D . 40 g NaOH 溶解在 1 L 水中,得到溶液的物质的量浓度为 1 mol/L
下列说法错误的是( )
A . 32 g O2所含的分子数目为NA
B . 0.5 mol H2SO4含有的原子总数目为3.5NA
C . HNO3的摩尔质量是63 g
D . 0.5NA个氯气(Cl2)分子的物质的量是0.5 mol
下列物质中,不能由单质直接化合生成的是( )
A . 氯化铁
B . 氯化氢
C . 氯化亚铁
D . 氯化铜
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A . 将NaHCO3固体加入新制氯水,有无色气泡(H+)
B . 使红色布条褪色(HCl)
C . 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D . 滴加AgNO3溶液生成白色沉淀(Cl-)
新制氯水的主要成分有Cl2、HClO、H+、Cl-等试用氯水的成分填空:
①氯水与NaBr溶液反应,起作用是
②氯水用于自来水杀菌消毒,起作用是
③氯水加入硝酸银溶液,出现白色沉淀,起作用是
④石蕊滴入氯水中,先变红后褪色,起作用是
化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
A . 二氧化硫有毒,严禁将其添加到任何食品和饮料中
B . 古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中提取青蒿素是利用氧化还原反应原理
C . 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为2∶1
D . 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但与氯气不同的是不产生有机氯对人体造成危害、
如图A处通入Cl2,当关闭B阀时,C处湿润的红布条没有明显变化,当打开B阀时,C处的湿润红布条逐渐褪色。则D瓶中盛装的溶液是 ( )
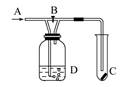
A . 浓硫酸
B . 水
C . 氢氧化钠溶液
D . 饱和食盐水
氯气是有毒的,曾被制成毒气弹用于侵略战争,当这种毒气弹顺风爆炸时,通常可用的防御方法是( )
A . 人应躲到低洼的地方
B . 人、畜应到较高的地方去
C . 人、畜应多饮豆浆和牛乳
D . 可用NaOH溶液浸湿软布蒙面
下列说法正确的是( )
A . 明矾可用作净水剂和消毒剂
B . 足量SO2通入Ba(NO3)2溶液中产生白色沉淀
C . NH3在足量的氧气中燃烧生成NO
D . 过量的铁与少量的氯气反应生成FeCl2
“84消毒液”的有效成分为NaClO,因其能杀灭病毒,是新冠肺炎期间常用的环境消毒剂。某化学学习小组为制备“84消毒液”设计了如图装置。并查阅到下列资料,“在加热情况下卤素和碱液发生如下反应:3X2+6OH-  5X-+
5X-+  +3H2O”。
+3H2O”。
 5X-+
5X-+  +3H2O”。
+3H2O”。 
回答下列问题:
-
(1) 仪器a的名称是。
-
(2) 圆底烧瓶内发生的离子方程式为。
-
(3) 装置中若省去盛装饱和NaCl溶液的洗气瓶,则会使产生的NaClO的量(填“不变”、“减少”或“增大”)。
-
(4) 装置中若撤去盛冰水的烧杯,则可能会使产生的NaClO的量(填“不变”、“减少”或“增大”)。
-
(5) 装置中的大试管内发生反应的离子方程式为。
-
(6) 使用“84消毒液”时须注意不要与洁厕灵(主要成分为盐酸)混合,否则会产生Cl2 , 请写出该反应的离子方程式。
-
(7) 对比(5)与(6)的反应可得,ClO-与Cl2的氧化性相对强弱与有关。
常温常压下,一氧化二氯(  )为棕黄色气体,沸点为3.8℃,42℃以上分解生成
)为棕黄色气体,沸点为3.8℃,42℃以上分解生成  和
和  ,
,  易溶于水并与水反应生成HClO。利用如图所示装置(部分夹持装置略去)将
易溶于水并与水反应生成HClO。利用如图所示装置(部分夹持装置略去)将  与空气(不参与反应)按体积比1∶3混合通入含水8%的
与空气(不参与反应)按体积比1∶3混合通入含水8%的  溶液中制备
溶液中制备  ,并用水吸收
,并用水吸收  制备HClO溶液。下列说法错误的是( )
制备HClO溶液。下列说法错误的是( )
 )为棕黄色气体,沸点为3.8℃,42℃以上分解生成
)为棕黄色气体,沸点为3.8℃,42℃以上分解生成  和
和  ,
,  易溶于水并与水反应生成HClO。利用如图所示装置(部分夹持装置略去)将
易溶于水并与水反应生成HClO。利用如图所示装置(部分夹持装置略去)将  与空气(不参与反应)按体积比1∶3混合通入含水8%的
与空气(不参与反应)按体积比1∶3混合通入含水8%的  溶液中制备
溶液中制备  ,并用水吸收
,并用水吸收  制备HClO溶液。下列说法错误的是( )
制备HClO溶液。下列说法错误的是( ) 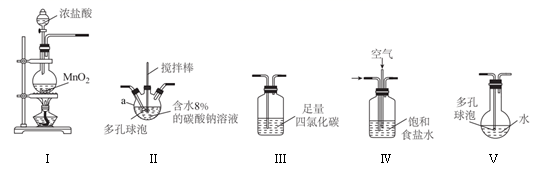
A . 装置合理的连接顺序为Ⅰ→Ⅳ→Ⅱ→Ⅲ→Ⅴ
B . 装置Ⅱ、Ⅴ中多孔球泡的作用均为防止倒吸
C . 装置Ⅲ的作用是除去  中的
中的  D . 制得的HClO溶液应保存在棕色试剂瓶中
D . 制得的HClO溶液应保存在棕色试剂瓶中
 中的
中的  D . 制得的HClO溶液应保存在棕色试剂瓶中
D . 制得的HClO溶液应保存在棕色试剂瓶中
下列说法中正确的是( )
A . CH4的摩尔质量为16g
B . 22 g二氧化碳与11.2 L HCl约含有相同的分子数
C . 在标准状况下,22.4 L水的质量约为18 g
D . 3.01×1023个SO2分子的质量约为32g
下列关于氯水的说法不正确的是( )
A . 向氯水中滴入 溶液,产生气泡说明氯水中含有
溶液,产生气泡说明氯水中含有 B . 氯水应用棕色试剂瓶避光保存
C . 氯水放置一段时间后酸性增强
D . 新制氯水具有漂白性是因为含有
B . 氯水应用棕色试剂瓶避光保存
C . 氯水放置一段时间后酸性增强
D . 新制氯水具有漂白性是因为含有
 溶液,产生气泡说明氯水中含有
溶液,产生气泡说明氯水中含有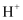 B . 氯水应用棕色试剂瓶避光保存
C . 氯水放置一段时间后酸性增强
D . 新制氯水具有漂白性是因为含有
B . 氯水应用棕色试剂瓶避光保存
C . 氯水放置一段时间后酸性增强
D . 新制氯水具有漂白性是因为含有
为了探究氯水能否和碳酸钡发生反应,某学生设计并完成了如下实验:
【实验一】向盛有饱和氯水的烧杯中加入足量碳酸钡,并充分搅拌,观察到氯水的黄绿色褪去并同时产生气体a。
【实验二】取实验一后烧杯中清液,分别进行如下实验:①往该清液中滴加盐酸时有大量气体产生,其主要成分为气体b;②往该清液中滴加硫酸钠溶液有白色沉淀产生;③将该清液滴在蓝色石蕊试纸上,试纸先变红后褪色。回答下列问题:
-
(1) 写出气体的化学式:a,b
-
(2) 在实验二中,清液使蓝色石蕊试纸先变红后褪色说明该清液中含有(填化学式);清液中滴加硫酸钠溶液产生白色沉淀,该反应的离子方程式为。
-
(3) 实验二中所得气体b可用右图所示装置净化。

①b中所含杂质气体为(填化学式)。
②如果连接在该装置之后的另一活塞发生堵塞,则长颈漏斗中出现的现象为。
-
(4) 写出产生气体b的反应的离子方程式。
-
(5) 通过上述实验,可推知氯水和碳酸钡反应的化学方程式为。
最近更新



