2.2 海水中的氯 知识点题库
哥本哈根气候大会的中心议题是“节能减排”,美国二氧化碳排放量居世界之首,人均年排放CO2约20吨,20吨CO2在标准状况下的体积为
A . 2×107L
B .  L
C . 2×107×22.4 L
D .
L
C . 2×107×22.4 L
D .  ×22.4 L
×22.4 L
 L
C . 2×107×22.4 L
D .
L
C . 2×107×22.4 L
D .  ×22.4 L
×22.4 L
标准状态下,在四个干躁的烧瓶中分别充入:①纯净的氨气,②混有 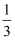 体积空气的氯化氢气体,③纯净的NO2气体,④混有少量O2的NO2气体.然后各做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
体积空气的氯化氢气体,③纯净的NO2气体,④混有少量O2的NO2气体.然后各做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
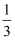 体积空气的氯化氢气体,③纯净的NO2气体,④混有少量O2的NO2气体.然后各做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
体积空气的氯化氢气体,③纯净的NO2气体,④混有少量O2的NO2气体.然后各做喷泉实验.实验后,三烧瓶中溶液的物质的量浓度大小关系是( )
A . ①=②=③=④
B . ①=②=③>④
C . ①=②=③<④
D . ④>①=②>③
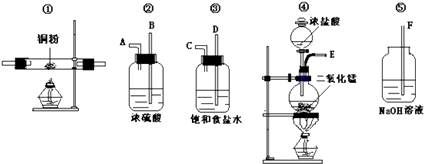
实验室中用下列仪器和药品来制取纯净的氯气,进而制取CuCl2 , 图中的A,B,C,D,E,F表示玻璃管接口,接口的弯曲和伸长部分未画出.
-
(1) 如果所制气体从左到右流向,上述各仪器装置正确连接顺序是(填序号);其中②与③装置相连时,玻璃管口应是接(填字母)
-
(2) 装置⑤发生反应的离子方程式.
-
(3) 装置④发生的化学方程式为.此反应中,氧化剂和还原剂的物质的量之比为.每生成标准状况下11.2L气体,转移电子的物质的量为.
87g二氧化锰与足量浓盐酸反应和足量二氧化锰与含4mol HCl的浓盐酸反应,哪个生成的氯气多?(填“前者”或“后者”),原因.
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是( )
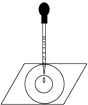
A . 此实验表明氯水具有酸性、漂白性
B . 内环呈白色,外环呈红色或浅红
C . 内外环上颜色的差异表明氯水中含有H+、HClO 等粒子
D . 久置的氯水滴到蓝色石蕊试纸上,会出现与上述相同的现象
下列关于元素化合物性质的叙述正确的是( )
A . Fe在少量Cl2中燃烧生成FeCl3
B . Al2O3和Fe2O3均可与NaOH溶液反应
C . SiO2与酸、碱均不发生反应
D . 二氧化硫、氯水均有漂白作用,其原理相同
下列说法不正确的是( )
A . 氯气可用于合成药物
B . 碳酸钠可用于治疗胃酸过多
C . 高压钠灯常用来广场照明
D . 镁合金密度小强度大可用于制飞机零部件
设  表示阿伏加德罗常数的值,下列叙述错误的是
表示阿伏加德罗常数的值,下列叙述错误的是 

 表示阿伏加德罗常数的值,下列叙述错误的是
表示阿伏加德罗常数的值,下列叙述错误的是 

A . 标准状况下,  氯气与足量水反应,转移电子数目为
氯气与足量水反应,转移电子数目为  B .
B .  中含有的质子数为
中含有的质子数为  C . 12g金刚石中含有的共价键数为
C . 12g金刚石中含有的共价键数为 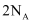 D . 标准状况下,
D . 标准状况下,  氟化氢中含有氟原子的数目大于
氟化氢中含有氟原子的数目大于 
 氯气与足量水反应,转移电子数目为
氯气与足量水反应,转移电子数目为  B .
B .  中含有的质子数为
中含有的质子数为  C . 12g金刚石中含有的共价键数为
C . 12g金刚石中含有的共价键数为 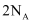 D . 标准状况下,
D . 标准状况下,  氟化氢中含有氟原子的数目大于
氟化氢中含有氟原子的数目大于 
下列说法中正确的是( )
A . 硅主要以单质、氧化物、硅酸盐的形式存在于自然界中
B . 青铜是我国使用最早的合金,钢是用量最大、用途最广泛的合金
C . 铁容器可以盛放浓盐酸、浓硝酸、浓硫酸
D . 漂白粉、漂粉精可用来漂白棉、麻、纸张,不能用作游泳池及环境的消毒剂
下列物质性质与应用对应关系正确的是( )
A . 次氯酸有酸性,可用于漂白、杀菌消毒
B . 二氧化硫具有漂白性,可用于粉丝、木耳等的漂白
C . 液氨汽化时要吸收大量的热,工业上可用作制冷剂
D . 晶体硅的熔点高、硬度大,可用于制作半导体材料
下列不能使有色布条褪色的物质是( )
A . 氯水
B . 氯化钙溶液
C . 漂白粉溶液
D . 次氯酸钠溶液
将一定量的氯气通入 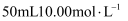 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、  共存体系(不考虑氯气和水的反应)。下列说法正确的是( )
共存体系(不考虑氯气和水的反应)。下列说法正确的是( )
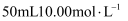 的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后,溶液中形成NaCl、NaClO、  共存体系(不考虑氯气和水的反应)。下列说法正确的是( )
共存体系(不考虑氯气和水的反应)。下列说法正确的是( )
A . 若反应中转移的电子为n mol,则 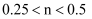 B . 溶液中
B . 溶液中  可能为
可能为  C . 与NaOH反应的氯气物质的量:
C . 与NaOH反应的氯气物质的量:  D . 当溶液中
D . 当溶液中  时,反应的离子方程式为:
时,反应的离子方程式为: 
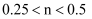 B . 溶液中
B . 溶液中  可能为
可能为  C . 与NaOH反应的氯气物质的量:
C . 与NaOH反应的氯气物质的量:  D . 当溶液中
D . 当溶液中  时,反应的离子方程式为:
时,反应的离子方程式为: 
75%的酒精、“84”消毒液、双氧水等化学品均是抗疫期间常用的消毒剂。下列有关“84”消毒液(NaClO和NaCl混合溶液)的叙述正确的是( )
A . 该溶液中,H+、  、
、  、I-可以大量共存
B . 该溶液中,Ag+、K+、
、I-可以大量共存
B . 该溶液中,Ag+、K+、  、CH3CH2OH可以大量共存
C . 向该溶液中加入浓盐酸,会产生黄绿色气体Cl2
D . 向该溶液中滴入少量FeSO4溶液的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
、CH3CH2OH可以大量共存
C . 向该溶液中加入浓盐酸,会产生黄绿色气体Cl2
D . 向该溶液中滴入少量FeSO4溶液的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
 、
、  、I-可以大量共存
B . 该溶液中,Ag+、K+、
、I-可以大量共存
B . 该溶液中,Ag+、K+、  、CH3CH2OH可以大量共存
C . 向该溶液中加入浓盐酸,会产生黄绿色气体Cl2
D . 向该溶液中滴入少量FeSO4溶液的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
、CH3CH2OH可以大量共存
C . 向该溶液中加入浓盐酸,会产生黄绿色气体Cl2
D . 向该溶液中滴入少量FeSO4溶液的离子方程式为:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O
下列说法中正确的是( )
A . 水被冷却到0℃以下时变成冰,是因为水分子大小发生了变化
B . 所有物质在温度变化时都能表现出三态变化
C . 通过压强变化能使气体变成液体
D . 同温同压下,两种气体的体积不相同,其主要原因是分子间的平均距离不同
某学习小组为探究甲烷与氯气的反应,设计了如图装置

回答下列问题:
-
(1) 装置B中发生反应的化学方程式为。
-
(2) 装置C的作用是。
-
(3) 装置E中经过高压汞灯的强光照射后,生成的含氯有机物最多有种,且E中实验现象有。
-
(4) F中球形干燥管的作用是。
-
(5) 某同学取反应后F中的溶液,加入足量硝酸酸化的硝酸银溶液,产生白色沉淀,就证明甲烷与氯气发生了取代反应,你认为是否合理,请说明理由。
下列实验现象的叙述正确的是( )
A . H2在Cl2中燃烧,发出黄色火焰
B . 向氯水中滴加AgNO3溶液,产生白色沉淀
C . 将Cu加入浓硫酸中,立即有大量气泡产生
D . 将铜丝在酒精灯上灼烧至红热,立即插入乙醇中,铜丝变为黑色
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol·L-1和2mol·L-1 , 取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(假设反应中HNO3的还原产物全部为NO)( )
A . 224mL
B . 448mL
C . 672mL
D . 896mL
设  为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A . 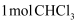 含有
含有 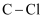 键的数目为
键的数目为 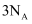 B .
B .  的盐酸含有阴离子总数为
的盐酸含有阴离子总数为  C .
C . 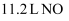 与
与 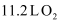 混合后的分子数目为
混合后的分子数目为  D .
D .  与足量
与足量  反应生成的
反应生成的  分子数目为
分子数目为 
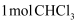 含有
含有 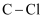 键的数目为
键的数目为 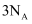 B .
B .  的盐酸含有阴离子总数为
的盐酸含有阴离子总数为  C .
C . 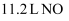 与
与 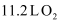 混合后的分子数目为
混合后的分子数目为  D .
D .  与足量
与足量  反应生成的
反应生成的  分子数目为
分子数目为 
新冠肺炎对生产生活带来了巨大冲击。医用酒精、含  的消毒液可用于个人与环境消毒,但含
的消毒液可用于个人与环境消毒,但含  的消毒液与医用酒精不可混用,混用会产生有毒气体
的消毒液与医用酒精不可混用,混用会产生有毒气体  ,发生的主要反应为:①
,发生的主要反应为:①  ,②……(后续反应略)。
,②……(后续反应略)。
 的消毒液可用于个人与环境消毒,但含
的消毒液可用于个人与环境消毒,但含  的消毒液与医用酒精不可混用,混用会产生有毒气体
的消毒液与医用酒精不可混用,混用会产生有毒气体  ,发生的主要反应为:①
,发生的主要反应为:①  ,②……(后续反应略)。
,②……(后续反应略)。 下列关于氯气和新制氯水的说法正确的是( )
A . 足量铁丝在  中燃烧生成
中燃烧生成  B . 向加有淀粉的
B . 向加有淀粉的  溶液中通入少量
溶液中通入少量  后溶液变蓝,说明
后溶液变蓝,说明  的氧化性强于
的氧化性强于  C .
C .  溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有
溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有  D . 用强光照射新制氯水一段时间后,溶液
D . 用强光照射新制氯水一段时间后,溶液  增大
增大
 中燃烧生成
中燃烧生成  B . 向加有淀粉的
B . 向加有淀粉的  溶液中通入少量
溶液中通入少量  后溶液变蓝,说明
后溶液变蓝,说明  的氧化性强于
的氧化性强于  C .
C .  溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有
溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有  D . 用强光照射新制氯水一段时间后,溶液
D . 用强光照射新制氯水一段时间后,溶液  增大
增大
氯气对水一心一意,水偏弄成三分四离。”其中“三分四离”指的是新制氯水中的七种微粒,下列对新制氯水性质的描述与所含有的微粒,对应错误的是( )
| 选项 | 氯水的性质 | 对应微粒 |
| A | 氯水使紫色石蕊溶液先变红后褪色 | H+、Cl2 |
| B | 氯水中加入硝酸银溶液,有白色沉淀产生 | Cl- |
| C | 氯水中加入Na2CO3粉末,有气泡产生 | H+ |
| D | 氯水使淀粉碘化钾溶液的混合溶液变蓝 | Cl2 |
A . A
B . B
C . C
D . D
化学基本概念是学习化学的基石,请正确回答下列问题。
-
(1) 今有7种物质:①液态氯化氢 ②乙醇 ③熔融的KNO3 ④铜线 ⑤NaCl晶体 ⑥小苏打溶液 ⑦氨水。
属于电解质的是,属于非电解质的是能导电的是 。
-
(2) “四种基本反应类型与氧化还原反应的关系”如图所示:
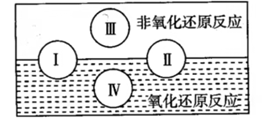
其中I为化合反应,IV是反应。
-
(3) 我国古代四大发明之一的黑火药是由硫粉、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+ 2KNO3 +3C=K2S+N2↑+3CO2↑,反应中被还原的物质是(填化学式)。
-
(4) NaH可在野外作生氢剂,反应原理为NaH+H2O=NaOH+ H2↑,该反应中氧化产物和还原产物的质量比为。
-
(5) 15.6gNa2X含有0.2molX2- , 含有Na+的物质的量是,Na2X的摩尔质量为。
-
(6) 工业制备漂白粉原理是(用化学方程式表示)。
最近更新



