3.3 е…ұд»·й”® зҹҘиҜҶзӮ№йўҳеә“

-
пјҲ1пјү дёӢеҲ—зү©иҙЁдёӯпјҡдә’дёәеҗҢзҙ ејӮеҪўдҪ“зҡ„жңүВ пјҲеЎ«еәҸеҸ·пјҢдёӢеҗҢпјүпјҢеұһдәҺеҗҢдҪҚзҙ зҡ„жңүпјҢеұһдәҺеҗҢдёҖз§Қзү©иҙЁзҡ„жңүпјҺ
в‘ ж¶Іж°Ҝе’Ңж°Ҝж°”В В в‘Ў16OгҖҒ17Oе’Ң18OВ в‘ўйҮ‘еҲҡзҹідёҺвҖңи¶ізҗғзғҜвҖқC60в‘ЈзҷҪзЈ·е’ҢP4в‘ӨO2дёҺO3в‘ҘDдёҺT
-
пјҲ2пјү дёӢеҲ—еҸҳеҢ–дёӯв‘ NaCl жә¶дәҺж°ҙВ в‘ЎHCl жә¶дәҺж°ҙВ в‘ўO2жә¶дәҺж°ҙВ в‘ЈNa2O2жә¶дәҺж°ҙ
в‘ӨI2еҚҮеҚҺ в‘ҘеӣәдҪ“NaOHзҶ”еҢ–пјҺпјҲ еЎ«еәҸеҸ·пјү
1пјүжңӘеҸ‘з”ҹеҢ–еӯҰй”®з ҙеқҸзҡ„жҳҜпјҢ
2пјүд»…еҸ‘з”ҹзҰ»еӯҗй”®з ҙеқҸзҡ„жҳҜпјҢ
3пјүд»…еҸ‘з”ҹе…ұд»·й”®з ҙеқҸзҡ„жҳҜпјҢ
4пјүж—ўеҸ‘з”ҹзҰ»еӯҗй”®з ҙеқҸпјҢеҸҲеҸ‘з”ҹе…ұд»·й”®з ҙеқҸзҡ„жҳҜпјҺ
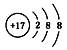 B . 6дёӘиҙЁеӯҗ8дёӘдёӯеӯҗзҡ„зўіе…ғзҙ зҡ„ж ёзҙ з¬ҰеҸ·пјҡ12C
C . ж°ҜеҢ–й•Ғзҡ„з”өеӯҗејҸпјҡ[
B . 6дёӘиҙЁеӯҗ8дёӘдёӯеӯҗзҡ„зўіе…ғзҙ зҡ„ж ёзҙ з¬ҰеҸ·пјҡ12C
C . ж°ҜеҢ–й•Ғзҡ„з”өеӯҗејҸпјҡ[  C . ж°ҜеҢ–й•Ғзҡ„з”өеӯҗејҸпјҡ
C . ж°ҜеҢ–й•Ғзҡ„з”өеӯҗејҸпјҡ -
пјҲ1пјү Snдёәв…ЈAж—Ҹе…ғзҙ пјҢеҚ•иҙЁSnдёҺе№ІзҮҘCl2еҸҚеә”з”ҹжҲҗSnCl4гҖӮеёёжё©еёёеҺӢдёӢSnCl4дёәж— иүІж¶ІдҪ“пјҢSnCl4з©әй—ҙжһ„еһӢдёәпјҢе…¶еӣәдҪ“зҡ„жҷ¶дҪ“зұ»еһӢдёәгҖӮ
-
пјҲ2пјү NH3гҖҒPH3гҖҒAsH3зҡ„жІёзӮ№з”ұй«ҳеҲ°дҪҺзҡ„йЎәеәҸдёә(еЎ«еҢ–еӯҰејҸпјҢдёӢеҗҢ)пјҢиҝҳеҺҹжҖ§з”ұејәеҲ°ејұзҡ„йЎәеәҸдёәпјҢй”®и§’з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәгҖӮ
-
пјҲ3пјү еҗ«жңүеӨҡдёӘй…ҚдҪҚеҺҹеӯҗзҡ„й…ҚдҪ“дёҺеҗҢдёҖдёӯеҝғзҰ»еӯҗ(жҲ–еҺҹеӯҗ)йҖҡиҝҮиһҜеҗҲй…ҚдҪҚжҲҗзҺҜиҖҢеҪўжҲҗзҡ„й…ҚеҗҲзү©дёәиһҜеҗҲзү©гҖӮдёҖз§ҚCd2+й…ҚеҗҲзү©зҡ„з»“жһ„еҰӮеӣҫжүҖзӨәпјҢ1molиҜҘй…ҚеҗҲзү©дёӯйҖҡиҝҮиһҜеҗҲдҪңз”ЁеҪўжҲҗзҡ„й…ҚдҪҚй”®жңүmolпјҢиҜҘиһҜеҗҲзү©дёӯNзҡ„жқӮеҢ–ж–№ејҸжңүз§ҚгҖӮ

-
пјҲ4пјү д»Ҙжҷ¶иғһеҸӮж•°дёәеҚ•дҪҚй•ҝеәҰе»әз«Ӣзҡ„еқҗж Үзі»еҸҜд»ҘиЎЁзӨәжҷ¶иғһдёӯеҗ„еҺҹеӯҗзҡ„дҪҚзҪ®пјҢз§°дҪңеҺҹеӯҗзҡ„еҲҶж•°еқҗж ҮгҖӮеӣӣж–№жҷ¶зі»CdSnAs2зҡ„жҷ¶иғһз»“жһ„еҰӮеӣҫжүҖзӨәпјҢжҷ¶иғһжЈұиҫ№еӨ№и§’еқҮдёә90В°пјҢжҷ¶иғһдёӯйғЁеҲҶеҺҹеӯҗзҡ„еҲҶж•°еқҗж ҮеҰӮдёӢиЎЁжүҖзӨәгҖӮ
еқҗж Ү
еҺҹеӯҗ
x
y
z
Cd
0
0
0
Sn
0
0
0.5
As
0.25
0.25
0.125

дёҖдёӘжҷ¶иғһдёӯжңүдёӘSnпјҢжүҫеҮәи·қзҰ»Cd(0пјҢ0пјҢ0)жңҖиҝ‘зҡ„Sn(з”ЁеҲҶж•°еқҗж ҮиЎЁзӨә)гҖӮCdSnAs2
жҷ¶дҪ“дёӯдёҺеҚ•дёӘSnй”®еҗҲзҡ„AsжңүдёӘгҖӮ
-
пјҲ1пјү Caе°ҸдәҺTiзҡ„жҳҜ____пјҲеЎ«ж ҮеҸ·пјүгҖӮA . жңҖеӨ–еұӮз”өеӯҗж•° B . жңӘжҲҗеҜ№з”өеӯҗж•° C . еҺҹеӯҗеҚҠеҫ„ D . 第дёүз”өзҰ»иғҪ
-
пјҲ2пјү з”ұOгҖҒClе…ғзҙ еҸҜз»„жҲҗдёҚеҗҢзҡ„еҚ•иҙЁе’ҢеҢ–еҗҲзү©пјҢе…¶дёӯCl2O2иғҪз ҙеқҸиҮӯж°§еұӮгҖӮ
в‘ Cl2O2зҡ„жІёзӮ№жҜ”H2O2дҪҺпјҢеҺҹеӣ жҳҜгҖӮ
в‘Ў O3еҲҶеӯҗдёӯеҝғеҺҹеӯҗжқӮеҢ–зұ»еһӢдёәпјӣO3жҳҜжһҒжҖ§еҲҶеӯҗпјҢзҗҶз”ұжҳҜгҖӮ
-
пјҲ3пјү Na3OClеҸҜз”ұд»ҘдёӢдёӨз§Қж–№жі•еҲ¶еҫ—пјҡ
ж–№жі•в… Na2O + NaCl
 Na3OCl
Na3OClж–№жі•II 2Na + 2NaOH + 2NaCl
 2Na3OCl + H2вҶ‘
2Na3OCl + H2вҶ‘в‘ Na2Oзҡ„з”өеӯҗејҸдёәгҖӮ
в‘Ў еңЁж–№жі•в…Ўзҡ„еҸҚеә”дёӯпјҢеҪўжҲҗзҡ„еҢ–еӯҰй”®жңүпјҲеЎ«ж ҮеҸ·пјүгҖӮ
AпјҺйҮ‘еұһй”® BпјҺзҰ»еӯҗй”® CпјҺй…ҚдҪҚй”® DпјҺжһҒжҖ§й”® EпјҺйқһжһҒжҖ§й”®
-
пјҲ4пјү Na3OClжҷ¶дҪ“еұһдәҺз«Ӣж–№жҷ¶зі»пјҢе…¶жҷ¶иғһз»“жһ„еҰӮеҸіжүҖзӨәгҖӮе·ІзҹҘпјҡжҷ¶иғһеҸӮж•°дёәa nmпјҢеҜҶеәҰдёәd gВ·cmпјҚ3гҖӮ

в‘ Na3OClжҷ¶иғһдёӯпјҢClдҪҚдәҺеҗ„йЎ¶зӮ№дҪҚзҪ®пјҢNaдҪҚдәҺдҪҚзҪ®пјҢдёӨдёӘNaд№Ӣй—ҙзҡ„жңҖзҹӯи·қзҰ»дёәnmгҖӮ
в‘Ўз”ЁaгҖҒdиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјNA=пјҲеҲ—и®Ўз®—ејҸпјүгҖӮ


 жҷ¶иғһдёӯпјҢдёҺ
жҷ¶иғһдёӯпјҢдёҺ жңҖйӮ»иҝ‘зӯүи·қзҰ»зҡ„
жңҖйӮ»иҝ‘зӯүи·қзҰ»зҡ„ жңү6дёӘ
B . еңЁе№ІеҶ°жҷ¶дҪ“дёӯпјҢжҜҸдёӘжҷ¶иғһжӢҘжңү6дёӘ
жңү6дёӘ
B . еңЁе№ІеҶ°жҷ¶дҪ“дёӯпјҢжҜҸдёӘжҷ¶иғһжӢҘжңү6дёӘ еҲҶеӯҗ
C . еңЁйҮ‘еҲҡзҹіжҷ¶дҪ“дёӯпјҢзўіеҺҹеӯҗдёҺзўізўій”®дёӘж•°жҜ”дёә
еҲҶеӯҗ
C . еңЁйҮ‘еҲҡзҹіжҷ¶дҪ“дёӯпјҢзўіеҺҹеӯҗдёҺзўізўій”®дёӘж•°жҜ”дёә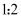 D . иҜҘж°”жҖҒеӣўз°ҮеҲҶеӯҗзҡ„еҢ–еӯҰејҸдёә
D . иҜҘж°”жҖҒеӣўз°ҮеҲҶеӯҗзҡ„еҢ–еӯҰејҸдёә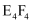
 зҡ„з”өеӯҗејҸпјҡ
зҡ„з”өеӯҗејҸпјҡ C . з”Ёз”өеӯҗејҸиЎЁзӨә
C . з”Ёз”өеӯҗејҸиЎЁзӨә зҡ„еҪўжҲҗиҝҮзЁӢпјҡ
зҡ„еҪўжҲҗиҝҮзЁӢпјҡ ж ёеӨ–жңүaдёӘз”өеӯҗпјҢbдёӘдёӯеӯҗпјҢMзҡ„еҺҹеӯҗз¬ҰеҸ·дёә
ж ёеӨ–жңүaдёӘз”өеӯҗпјҢbдёӘдёӯеӯҗпјҢMзҡ„еҺҹеӯҗз¬ҰеҸ·дёә
 й”®пјҢеҸҜиғҪжңү
й”®пјҢеҸҜиғҪжңү й”®
B . е…ұд»·жҷ¶дҪ“дёӯеҗ„зӣёйӮ»еҺҹеӯҗй—ҙзҡ„еҢ–еӯҰй”®йғҪжҳҜе…ұд»·й”®
C . йҮ‘еұһе…ғзҙ е’ҢйқһйҮ‘еұһе…ғзҙ й—ҙеҸҜд»ҘеҪўжҲҗе…ұд»·й”®
D .
й”®
B . е…ұд»·жҷ¶дҪ“дёӯеҗ„зӣёйӮ»еҺҹеӯҗй—ҙзҡ„еҢ–еӯҰй”®йғҪжҳҜе…ұд»·й”®
C . йҮ‘еұһе…ғзҙ е’ҢйқһйҮ‘еұһе…ғзҙ й—ҙеҸҜд»ҘеҪўжҲҗе…ұд»·й”®
D .  еҲҶеӯҗдёӯ
еҲҶеӯҗдёӯ й”®ж— ж–№еҗ‘жҖ§пјҢ
й”®ж— ж–№еҗ‘жҖ§пјҢ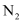 еҲҶеӯҗдёӯзҡ„
еҲҶеӯҗдёӯзҡ„ й”®жңүж–№еҗ‘жҖ§
й”®жңүж–№еҗ‘жҖ§



