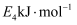第四章 剖析物质变化中的能量变化 知识点题库
-
(1) 由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是(填“锌”或“铜”),发生反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为(用对数表示)。
-
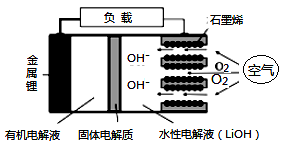
(2) 如图是某燃料电池的示意图,请回答:
①在导线中电子流动方向为(用a、b表示)。
②该燃料电池的负极反应式为。
-
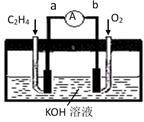
(3) 如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做极,C电极的反应式为。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成(包括成分和体积)。
①理论上每消耗标准状况下 22.4L 的CH4 , 可以向外电路提供 8mole-
②负极上是 O2 获得电子,电极反应式为O2+4e-+2H2O=4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的 pH 不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极会出现淡蓝色火焰
⑦电解质溶液中 OH-向负极移动,K+向正极移动
⑧该电池的总反应为CH4+2O2=CO2+2H2O
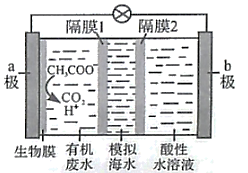
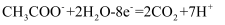 B . 隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C . 当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D . 电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
B . 隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C . 当电路中转移1mol电子时,模拟海水理论上除盐58.5g
D . 电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
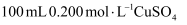 溶液与
溶液与 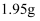 锌粉在量热计中充分反应。测得反应前温度为
锌粉在量热计中充分反应。测得反应前温度为 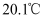 ,反应后最高温度为
,反应后最高温度为 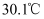 。
。 已知:反应前后,溶液的比热容均近似为  、溶液的密度均近似为
、溶液的密度均近似为 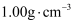 ,忽略溶液体积、质量变化和金属吸收的热量。请计算:
,忽略溶液体积、质量变化和金属吸收的热量。请计算:
-
(1) 反应放出的热量
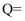 J。
J。
-
(2) 反应
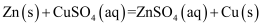 的
的 
 (列式计算)。
(列式计算)。
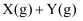
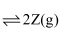 分别在①、②、③三种不同实验条件下进行,它们的起始浓度为
分别在①、②、③三种不同实验条件下进行,它们的起始浓度为 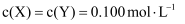 及
及  ,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法错误的是( )
,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法错误的是( ) 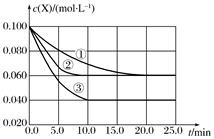
 时实验③的反应速率最快
B . 条件②的反应最先达到平衡
C . ②与①比较可能是压强更大
D . 该反应的正反应是吸热反应
时实验③的反应速率最快
B . 条件②的反应最先达到平衡
C . ②与①比较可能是压强更大
D . 该反应的正反应是吸热反应
-
(1) 碱性电池具有耐用、电流量大、储存寿命长、外壳不易腐蚀等优点。铝-铜碱性原电池的工作原理如装置甲所示:
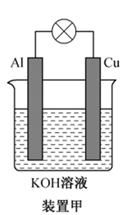
①在(“Al”或“Cu”)极有H2生成,Al极电极反应式为。
②若有33.6 L(标准状况下)H2生成,则理论上电解质溶液增重g。
-
(2) 某兴趣小组设计以甲烷、氧气酸性燃料电池为电源电解NaCl溶液,并验证氯气的某种化学性质,工作原理如装置乙、装置丙所示。
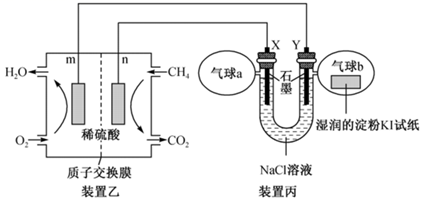
①m极为极,装置乙发生反应的化学方程式为。
②Y极电极反应式为。
③气球b中的现象为。
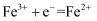 B . 工作时,溶液中
B . 工作时,溶液中  向b极移动
C . 若消耗8g氧气,电路中转移1mol电子
D . 总反应为
向b极移动
C . 若消耗8g氧气,电路中转移1mol电子
D . 总反应为 
a)CH4(g)+CO2(g)  2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g)  CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c)CH4(g)  C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d)2CO(g)  CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e)CO(g)+H2(g)  H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
-
(1) 根据盖斯定律,反应a的∆H1=(写出一个代数式即可)。
-
(2) 上述反应体系在一定条件下建立平衡后,下列说法正确的有_______。A . 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 B . 移去部分C(s),反应c、d、e的平衡均向右移动 C . 加入反应a的催化剂,可提高CH4的平衡转化率 D . 降低反应温度,反应a~e的正、逆反应速率都减小
-
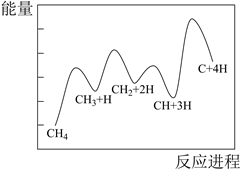
(3) 一定条件下,CH4分解形成碳的反应历程如图所示。该历程分步进行,其中,第步的正反应活化能最大。
-
(4) 设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K  随
随 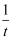 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。 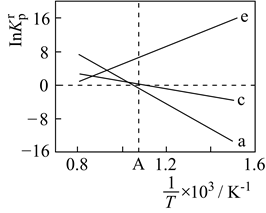
①反应a、c、e中,属于吸热反应的有(填字母)。
②反应c的相对压力平衡常数表达式为K
 =。
=。③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程。
-
(5) CO2用途广泛,写出基于其物理性质的一种用途:。
 与
与  反应的能量变化示意图,下列说法正确的是( )
反应的能量变化示意图,下列说法正确的是( ) 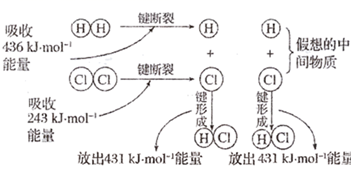
 B . 该反应既是氧化还原反应又是放热反应
C . 形成
B . 该反应既是氧化还原反应又是放热反应
C . 形成  键要吸收
键要吸收  的能量
D . 反应物断键时吸收的能量大于产物形成化学键时释放的能量
的能量
D . 反应物断键时吸收的能量大于产物形成化学键时释放的能量
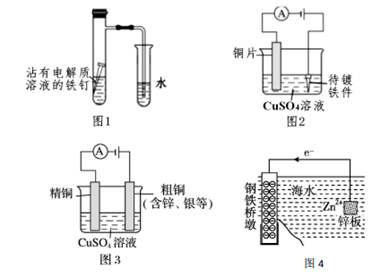
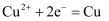 C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
C . 图 3:溶液中 c(Cu2+)增大
D . 图 4:采用了牺牲阳极的阴极保护法保护桥墩
-
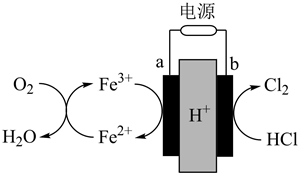
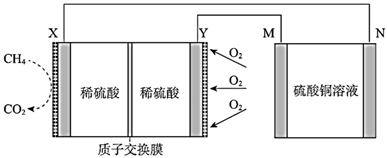
(1) X电极为(填“正极”或“负极”),该电极的电极反应式为。
-
(2) 放电过程中,
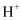 向(填“X极”或“Y极”)移动。
向(填“X极”或“Y极”)移动。
-
(3) 若用该燃料电池进行粗铜精炼,则M极连接的是(填“粗铜”或“精铜”),N极的电极反应式为。
-
(4) 若用该燃料电池进行电镀铜,则N极连接的是(填“镀件”或“精铜”),理论上每消耗
 甲烷时,M极变化(增加或减少)的质量为g。
甲烷时,M极变化(增加或减少)的质量为g。
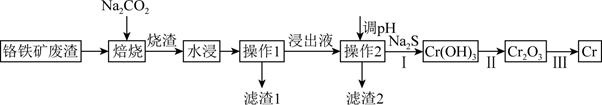
注:焙烧可将Al、Si氧化物转化为可溶性钠盐。
-
(1) 为加快“水浸”速率,可采取的措施为(写出一种即可)。
-
(2) 已知“浸出液”的主要成分为Na2CrO4 , 则Cr2O3焙烧时反应的化学方式为。
-
(3) 滤渣1的主要成分是。 实验室中进行操作2用到的玻璃仪器有。
-
(4) 常温下,溶液中部分离子的物质的量浓度的对数lgc与pH的关系如图所示。已知溶液中离子浓度≤10-5 mol/L时认为沉淀完全。
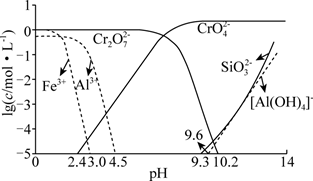
浸出液用H2SO4调节pH的最佳范围是。
调pH时
 转化的离子方程式为。
转化的离子方程式为。 -
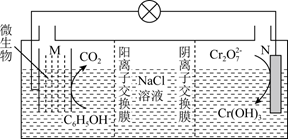
(5) 一定温度下,利用K2Cr2O7可实现含苯酚废水的有效处理,工作原理如图所示,负极电极反应式为,一段时间后,N极附近溶液pH(填“增大”、“减小”或“不变”)。
反应1:
反应2:

请回答下列问题:
-
(1) 已知几种物质的燃烧热数据如下:
物质




燃烧热
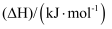
-890.3
-1299.5
-1411.0
-285.8
①能表示
 燃烧热的热化学方程式为。
燃烧热的热化学方程式为。②上述反应中,
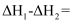
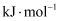 。
。 -
(2) 向恒温恒容密闭容器中充入适量
 , 发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是____(填标号)。
A . 气体总压强不随时间变化 B . 气体密度不随时间变化 C . 气体平均摩尔质量不随时间变化 D .
, 发生上述反应1和反应2。下列情况不能说明上述反应达到平衡状态的是____(填标号)。
A . 气体总压强不随时间变化 B . 气体密度不随时间变化 C . 气体平均摩尔质量不随时间变化 D . 体积分数不随时间变化
体积分数不随时间变化
-
(3) 实验测得
 的速率方程:
的速率方程: ,
,  (
(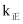 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时
分别为正、逆反应速率常数,只与温度、催化剂有关)。T1℃下反应达到平衡时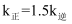 , T2℃下反应达到平衡时
, T2℃下反应达到平衡时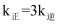 。由此推知,T1(填“>”、“<”或“=”)T2。
。由此推知,T1(填“>”、“<”或“=”)T2。
-
(4) 在密闭容器中充入
 , 发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内
, 发生上述反应1和反应2。在不同催化剂Cat1、Cat2作用下,测得单位时间内 的产率与温度的关系如图1。在其他条件相同时,催化效率较高的是(填“Cat1”或“Cat2“”)。在Cat2作用下,温度高于500℃时,
的产率与温度的关系如图1。在其他条件相同时,催化效率较高的是(填“Cat1”或“Cat2“”)。在Cat2作用下,温度高于500℃时, 的产率降低的可能原因是。
的产率降低的可能原因是。
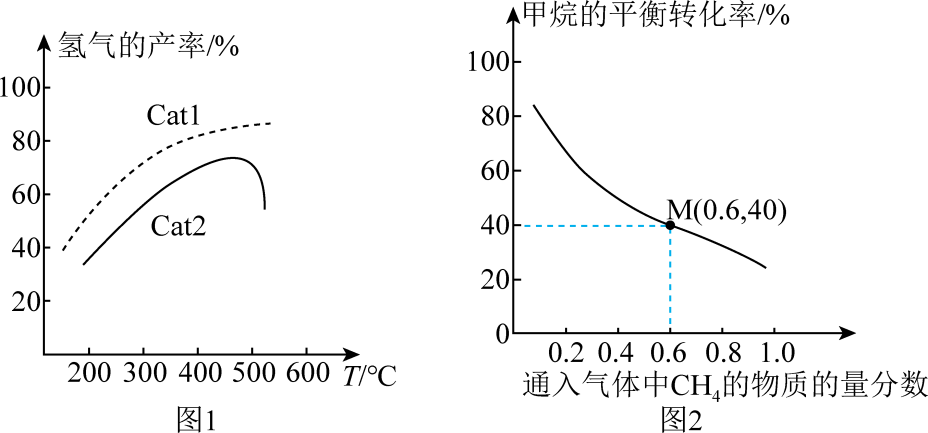
-
(5) 一定温度下,总压强恒定为121kPa时,向密闭容器中充入由
 和
和 组成的混合气体(
组成的混合气体( 不参与反应),同时发生反应1和反应2,测得
不参与反应),同时发生反应1和反应2,测得 的平衡转化率与通入气体中
的平衡转化率与通入气体中 的物质的量分数的关系如图2。
的物质的量分数的关系如图2。
①图2中,随着通入气体中
 的物质的量分数增大,甲烷的平衡转化率降低的主要原因是。
的物质的量分数增大,甲烷的平衡转化率降低的主要原因是。②已知M点对应的乙炔的选择性为75%[提示:乙炔的选择性
 ]。该温度下,反应2的平衡常数
]。该温度下,反应2的平衡常数 (结果保留2位有效数字)kPa。
(结果保留2位有效数字)kPa。提示:用平衡时气体分压计算的平衡常数为
 , 气体分压等于气体总压×气体的物质的量分数。
, 气体分压等于气体总压×气体的物质的量分数。
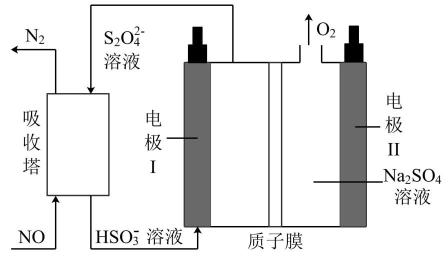
 +2e-=S2O
+2e-=S2O +2OH-
C . 电解过程中电极II附近溶液的pH减小
D . 工作时有0.4molH+通过质子膜时可处理4.48LNO
+2OH-
C . 电解过程中电极II附近溶液的pH减小
D . 工作时有0.4molH+通过质子膜时可处理4.48LNO
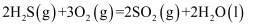
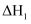
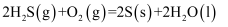

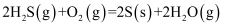

判断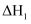 、
、 、
、 三者关系正确的是( )
三者关系正确的是( )
 B .
B .  C .
C . 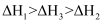 D .
D . 
 燃烧生成液态水放出
燃烧生成液态水放出 的热量,则下列热化学方程式书写正确的是( )
的热量,则下列热化学方程式书写正确的是( )

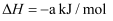 B .
B . 
 C .
C . 
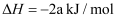 D .
D . 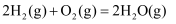
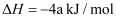
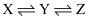 构成,它的反应能量曲线如图所示。下列有关叙述正确的是( )
构成,它的反应能量曲线如图所示。下列有关叙述正确的是( )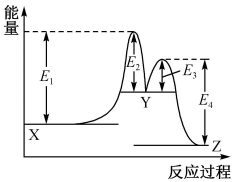
 、
、 、
、 三种物质中
三种物质中 最不稳定
C . 加入催化剂会改变两步反应的焓变
D .
最不稳定
C . 加入催化剂会改变两步反应的焓变
D . 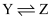 反应的活化能是
反应的活化能是