第四章 剖析物质变化中的能量变化 知识点题库
 O2(g)
O2(g)  SO3(g) ΔH=﹣98.32 kJ·
SO3(g) ΔH=﹣98.32 kJ·  ,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
 C . <196.64 kJ
D . >196.64 kJ
C . <196.64 kJ
D . >196.64 kJ

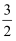 O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B . 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C . 2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D . CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) ΔH=-725.8 kJ/mol
B . 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ/mol
C . 2CH3OH+3O2=2CO2+4H2O(l) ΔH=-22.68 kJ/mol
D . CH3OH(l)+ 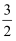 O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-725.8 kJ/mol
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题: 已知: ![]() (g) =
(g) = ![]() (g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
(g)+H2(g) ΔH1=100.3 kJ·mol −1 ①
H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应: ![]() (g)+ I2(g) =
(g)+ I2(g) = ![]() (g)+2HI(g) ③ ΔH3=kJ·mol −1。
(g)+2HI(g) ③ ΔH3=kJ·mol −1。
M2+(g)+CO  (g)
(g)  M²+(g)+O²-(g)+CO2(g)
M²+(g)+O²-(g)+CO2(g)
↑△H1 ↓△H3
MCO3(S)  MO(s)+CO2(g)
MO(s)+CO2(g)
已知:离子电荷相同时,半径越小,离子键越强。下列说法不正确的是( )

-
(1) 1mol甲烷(g)完全燃烧生成CO2(g)和H2O(l),放出890.3kJ热量:;
-
(2) 1molCO完全转化为CO2放出283kJ的热量:;
-
(3) N2(g)与H2(g)反应生成17gNH3(g),放出46.1kJ热量:;
-
(4) 24gC(s)与足量H2O(g)反应生成CO(g)和H2(g),吸收262.6kJ热量:。
-
(1) 氢气的燃烧热值高,H2(g) + 1/2O2(g) = H2O(g) △H = -241.8 kJ.mol-1.
化学键
H-H
O=O
O-H
键能(kJ·mol-1)
X
496.4
463
请根据相关数据计算:H-H的键能X=kJ·mol-1。
-
(2) 根据现代工业技术可以用H和CO反应来生产燃料甲醇,其反应方程式如下:CO2(g) + H2(g) =H2O + CH3OH(g) △H=-49.00 kJ·mol-1
一定温度下,在体积为1L的密闭容器中充入 1.00molCO2和3.00molH2 , 测得 CO2 和CH3OH 的浓度随时间变化如图所示。
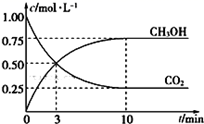
①能说明该反应已达平衡状态的是(填代号)
A CO2在混合气体中的体积分数保持不变
B 单位时间内每消耗1.2molH2 , 同时生成 0.4molH2O
C 混合气体平均相对分子质量不随时间的变化而变化
D 反应中H2O与CH3OH的物质的量浓度比为1:1,且保持不变
②从反应开始到平衡的平均反应速率V(H2)=,达到平衡时氢气的转化率为。
③下列的条件一定能加快反应速率并且提高H2转化率的是(填代号)。
A 升高反应温度 B 缩小容器的体积
C 保持容器体积不变,充入稀有气体 D 保持容器体积不变,充入CO2气体
-
(1) 已知:①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
③H2(g)+ 1/2O2(g)=H2O(g) ΔH3=-241.8kJ·mol-1
焦炭与水蒸气反应是:C(s)+H2O(g)=CO(g)+H2(g)△H= kJ·mol-1
-
(2) 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的发电装置,其工作原理是2H2+O2=2H2O
①若选用KOH溶液作电解质溶液,则正极通入的气体是,该电极的电极反应式为。
②若选用硫酸作电解质溶液,则负极的电极方程式为。
-
(3) 电解氯化钠溶液时,阳极的电极反应式为。
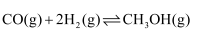
 。回答下列问题:
。回答下列问题:
-
(1) 已知




部分化学键的键能如表所示。
化学键
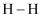
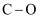

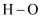
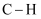

436
351
1076
463
x
则
 。
。 -
(2) 若按
 投料,将H与CO充入V L恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图1所示。
投料,将H与CO充入V L恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图1所示。 
已知:
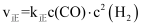 ,
,  ,其中
,其中  、
、  为速率常数,只与温度有关。
为速率常数,只与温度有关。①压强
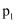 、
、  、
、  由小到大的顺序是。
由小到大的顺序是。②
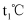 、压强为
、压强为  时,若向该容器中充入
时,若向该容器中充入 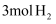 和3mol CO发生反应,5min后反应达到平衡(M点),则0~5min内,
和3mol CO发生反应,5min后反应达到平衡(M点),则0~5min内, 
 ,N点时的
,N点时的  。
。③X、Y、M、N四点对应的平衡常数从大到小的顺序是。
-
(3) 若向起始温度为325℃的10L恒容密闭容器中充入2mol CO和
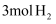 ,发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。平衡时温度与起始温度相同。
,发生反应,体系总压强(p)与时间(t)的关系如图2中曲线Ⅰ所示,曲线Ⅱ为只改变某一条件的变化曲线。平衡时温度与起始温度相同。 
①曲线Ⅱ所对应的改变的条件可能为。
②体系总压强先增大后减小的原因为。
③该条件下
 的平衡转化率为%(结果保留三位有效数字)。
的平衡转化率为%(结果保留三位有效数字)。
①TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH1>0
②C(s)+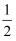 O2(g)=CO(g) ΔH2<0
O2(g)=CO(g) ΔH2<0
③
下列说法中正确的是( )
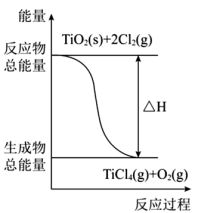

 D . 电池总反应的化学方程式为
D . 电池总反应的化学方程式为
 与水反应
C .
与水反应
C . 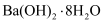 与
与  反应
D .
反应
D . 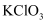 受热分解
受热分解
-
(1) 苯甲酸在A、B、C三种溶剂中的溶解度(S)随温度变化的曲线如图所示:

重结晶时,合适的溶剂是。 重结晶过程中,趁热过滤的作用是。洗涤时采用的合适洗涤剂是(填字母)。
A.饱和食盐水 B.Na2CO3溶液 C.稀硫酸 D.蒸馏水
-
(2) 检验乙烯时可用溴的四氯化碳溶液或用溴水,其现象的不同是。
-
(3) 实验室制取乙炔的反应方程式是。
-
(1) 工业上常用芒硝(
 )和煤粉在高温下生产硫化钠,同时生成
)和煤粉在高温下生产硫化钠,同时生成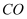 , 该反应的化学方程式为。
, 该反应的化学方程式为。
-
(2) 溶解回流装置如图所示,回流前无需加入沸石,其原因是。回流时,烧瓶内气雾上升高度不宜超过冷凝管高度的1/3。若气雾上升过高,可采取的措施是。
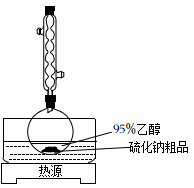
-
(3) 回流时间不宜过长,原因是。回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为(填标号)。
A. ①②③ B.③①② C.②①③ D.①③② -
(4) 该实验热过滤操作时,用锥形瓶而不能用烧杯接收滤液,其原因是。过滤除去的杂质为。若滤纸上析出大量晶体,则可能的原因是。
-
(5) 滤液冷却、结晶、过滤,晶体用少量洗涤,干燥,得到
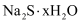 。
。
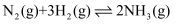
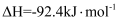 。相关化学键的键能(指气态分子中1mol化学键解离成气态原子所吸收的能量)如下表所示:下列说法错误的是( )
。相关化学键的键能(指气态分子中1mol化学键解离成气态原子所吸收的能量)如下表所示:下列说法错误的是( )化学键 |
|
|
|
键能/( | x | 436 | 391 |
 吸收能量
B . 过程
吸收能量
B . 过程 放出能量
C . x=945.6
D . 1molN(g)与足量H2(g)充分反应,放出92.4kJ的热量
放出能量
C . x=945.6
D . 1molN(g)与足量H2(g)充分反应,放出92.4kJ的热量

-
(1) 1mol的
 与适量的
与适量的 反应生成
反应生成 , 放出92.2kJ热量。。
, 放出92.2kJ热量。。
-
(2) 其他相关数据如下表:


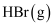
1mol分子中的化学键断裂时需要吸收的能量
436
230
369
写出1mol
 和1mol
和1mol 化合时的热化学方程式:。
化合时的热化学方程式:。 -
(3) 已知ag乙烯气体充分燃烧时生成1mol
 和液态水,放出bkJ的热量,则表示乙烯燃烧热的热化学方程式为:。
和液态水,放出bkJ的热量,则表示乙烯燃烧热的热化学方程式为:。
-
(4) 已知CO(g)和
 的燃烧热分别为283.0kJ/mol和726.5kJ/mol。请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
的燃烧热分别为283.0kJ/mol和726.5kJ/mol。请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:。
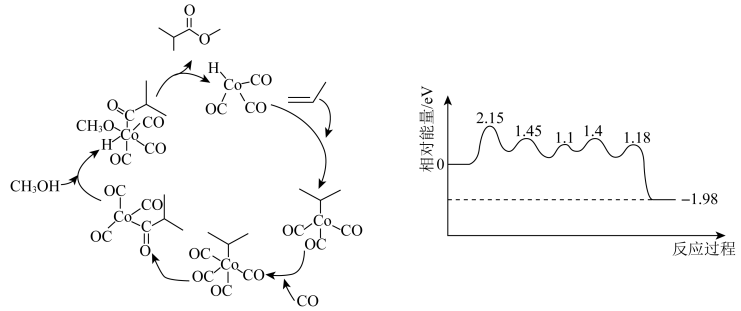

 B . 第一步反应决定了总反应的化学反应速率
C .
B . 第一步反应决定了总反应的化学反应速率
C .  是反应的催化剂
D .
是反应的催化剂
D .  的能量比1mol
的能量比1mol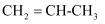 、1molCO、1mol
、1molCO、1mol 的总能量低
的总能量低
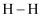

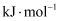 )
)


