第四章 剖析物质变化中的能量变化 知识点题库
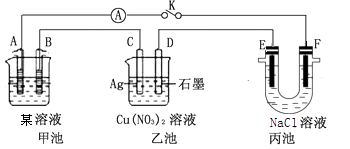
-
(1) 若甲池某溶液为稀H2SO4 , 闭合K时,电流表指针发生偏转,电极材料A为碳棒B为Fe,则:①A碳电极上发生的现象为。
②丙池中E、F电极均为碳棒,E电极为(填“正极”、“负极”、“阴极”或“阳极”)。如何检验F侧出口的产物。
-
(2) 若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的甲池原电池装置,则B(正极)电极反应式为。
-
(3) 若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,
①A电极的反应方程式为。
②若线路中转移0.02mol电子,乙池中C极质量变化g。
-
(4) 若用少量NaOH溶液吸收SO2气体,对产物NaHSO3进一步电解可制得硫酸,将丙池电解原理示意图改为如下图所示。电解时阳极的电极反应式为。


 2HI(g)
2HI(g) 
请回答下列问题:
-
(1) V=.
-
(2) 该反应达到最大限度了的时间是,该时间内平均反应速率v(HI)=。
-
(3) 该反应达到平衡状态时,(填“吸收”或“放出”)的热量为。
-
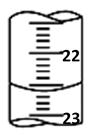
(1) Ⅰ.某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度
将5.0 g烧碱样品(杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,如图是某次滴定时的滴定管中的液面,其读数为 mL。
-
(2) 由下表数据得出NaOH的百分含量是。
滴定次数
待测NaOH溶液体积(mL)
标准盐酸体积
滴定前的刻度(mL)
滴定后的刻度(mL)
第一次
10.00
0.40
20.50
第二次
10.00
4.10
24.00
-
(3) Ⅱ.氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2 , 还原产物为Mn2+。
③终点时用去20 mL 1.0×10﹣4 mol/L的KMnO4溶液。
写出用KMnO4滴定H2C2O4的离子方程式。
-
(4) 滴定时,将KMnO4溶液装在(填“酸式”或“碱式”)滴定管中。
-
(5) 判断滴定终点的方法是。
-
(6) 误差分析:(填“偏高”、“偏低”或“无影响”)
①如果滴定管用蒸馏水洗后未用酸性KMnO4标准液润洗,则测量结果。
②滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则测量结果。
-
(7) 计算:血液中含钙离子的浓度为mol/L。
-
(8) Ⅲ.50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题:

从实验装置上看,图中缺少的一种玻璃用品是。如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测得的“中和热”数值将(填“偏大”、“偏小”或“无影响”)。
-
(9) 已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时,放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:。
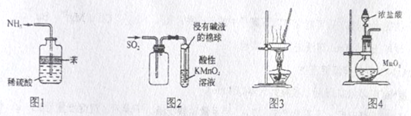
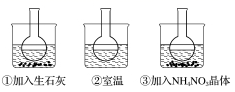
-
(1) 含酚酞的0.01 mol·L-1CH3COONa溶液显浅红色的原因为(用离子方程式解释)。
-
(2) 实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____________(填字母)。A . 水解反应为放热反应 B . 水解反应为吸热反应 C . NH4NO3溶于水时放出热量 D . NH4NO3溶于水时吸收热量
-
(3) 向0.01 mol·L-1CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为、、。(填“左”、“右”或“不移动”)
 O2(g)=CO(g)△H=-184.6kJ/mol(燃烧热)
D . NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol(反应热)
O2(g)=CO(g)△H=-184.6kJ/mol(燃烧热)
D . NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol(反应热)

 和
和  转化为“液态阳光”过程中同时释放能量
B . 煤气化得到的水煤气合成的甲醇不属于“液态阳光”
C . “液态阳光”行动有利于可持续发展并应对气候变化
D . “液态阳光”有望解决全球化石燃料不断枯竭的难题
转化为“液态阳光”过程中同时释放能量
B . 煤气化得到的水煤气合成的甲醇不属于“液态阳光”
C . “液态阳光”行动有利于可持续发展并应对气候变化
D . “液态阳光”有望解决全球化石燃料不断枯竭的难题
-
(1) 在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2 , 吸热131.5kJ:。
-
(2) 已知稀溶液中,1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式。
-
(3) 已知:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-196.6kJ·mol-1;
2NO(g)+O2(g)⇌2NO2(g) ΔH=-113.0kJ·mol-1
请写出NO2与SO2反应生成SO3和NO的热化学方程式。
-
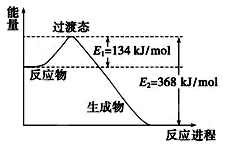
(4) 如图所示是NO2和CO反应生成CO2和NO过程中能量变化的示意图,请写出NO2和CO反应的热化学方程式:。
 )可用于制备乙炔(
)可用于制备乙炔( )。制备
)。制备 的原理为
的原理为
 。以海水为原料制备碳化镁的工艺如下:
。以海水为原料制备碳化镁的工艺如下:海水 溶液
溶液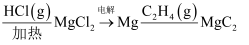
-
(1) 氢氧化镁浊液中混有少量
 , 提纯
, 提纯 的操作是。
的操作是。
-
(2) 电解熔融的
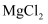 时,阳极上的电极反应式为。
时,阳极上的电极反应式为。
-
(3) 实验室制备HCl的原理是
 (浓)
(浓)
 , 用图1中的装置制备一瓶纯净的氯化氢。
, 用图1中的装置制备一瓶纯净的氯化氢。
①气流从左至右,装置导管口的连接顺序为(填标号)。
②D装置干燥管的作用是。
③C装置的反应中利用了浓硫酸的(填标号)。
a.难挥发性 b.强氧化性 c.吸水性
-
(4) 制备碳化镁的装置如图2所示(装置中试剂均足量)。
已知:
 , 副产物有
, 副产物有 、
、 等。
等。
①仪器M的名称是。
②B装置中的试剂是。F装置中集气瓶收集的气体有(除水蒸气外)(填化学式)。
③假设各物质完全反应,根据下列物理量可以计算出
 的质量的是(填标号)。
的质量的是(填标号)。a.乙醇的体积和密度 b.镁的质量 c.浓硫酸的体积和密度

反应I:
反应II:
-
(1) ①一定条件下,一氧化碳加氢生成甲醇的热化学方程式为:
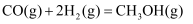
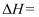
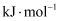 。
。②若反应II逆反应活化能Ea(逆)为120
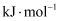 , 则该反应的Ea(正)活化能为
, 则该反应的Ea(正)活化能为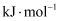 。
。 -
(2) ①反应I在催化剂M表面进行,其中CO2生成CH3OH的历程如下图所示(*表示吸附在催化剂表面的物种,TS表示过渡态,能量的单位为eV)。

下列说法正确的是。
A.在反应过程中有极性键的断裂
B.本历程共分为5步反应进行
C.本历程的决速步骤的反应为:

D.加入催化剂M可以提高甲醇的平衡产率
②在催化剂M表面进行反应I,当起始量
 时,在不同条件下达到平衡,体系中CO2的转化率为α(CO2),在T=400℃下α(CO2)随压强变化关系和在p=60MPa下α(CO2)随温度变化关系如下图所示。其中代表在T=400℃下α(CO2)随压强变化关系的是(填“a线”或“b线”);a、b两线的交点E对应的平衡常数(填“相同”或“不同”)。当α(CO2)为80%时,反应条件可能是。
时,在不同条件下达到平衡,体系中CO2的转化率为α(CO2),在T=400℃下α(CO2)随压强变化关系和在p=60MPa下α(CO2)随温度变化关系如下图所示。其中代表在T=400℃下α(CO2)随压强变化关系的是(填“a线”或“b线”);a、b两线的交点E对应的平衡常数(填“相同”或“不同”)。当α(CO2)为80%时,反应条件可能是。
-
(3) 温度为T℃时,在一个刚性容器中模拟工业上合成CH3OH,往容器中通入1molCO2、3molH2进行反应,反应过程中容器内的压强随着时间变化如下表所示。
时间/min
0
10
20
30
40
50
压强/MPa
120
105
95
90
88
88
(已知:CH3OH选择性=
 )
)请计算反应开始至40min的平均反应速率v(CH3OH)=MPa/min;此时CH3OH的选择性为80%,则反应I的压强平衡常数Kp=
 (只列计算式,压强平衡常数:用平衡分压代替平衡浓度,分压=总压
(只列计算式,压强平衡常数:用平衡分压代替平衡浓度,分压=总压 气体物质的量分数)。
气体物质的量分数)。



