第四章 剖析物质变化中的能量变化 知识点题库
键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 436 | 193 | 151 | 247 | 431 | 299 | 356 |
分析上表中的数据,下列结论正确的是( )
 CH4(g)+C3H6(g)
CH4(g)+C3H6(g)请回答下列问题
-
(1) 化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25℃、101kPa 几种有机物的生成热如下表所示:
物质
甲烷
乙烷
乙烯
丙烯
正丁烷
异丁烷
生成热/ kJ·mol-1
-75
-85
52
20
-125
-132
由正丁烷裂解生成乙烯的热化学方程式为。
-
(2) 一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况能说明该反应达到平衡状态的是(填标号)
A.气体密度保持不变
B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变
D.正丁烷分解速率利乙烷消耗速率相等
②为了提高反应速率和反应物的转化率,可采收的措施是。
-
(3) 向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等) 下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是。

-
(4) 在一定温度下向10L 恒容密闭容器中充入2mol 正丁烷,反应生成乙烯和乙烷,经过10min 达到平衡状态,测得平衡时气体压强是原来的1.75 倍。
①0~10min 内乙烷的生成速率v(C2H6)= mol·L-1·min-1
②上述条件下,正丁烷的平衡转化率为,该反应的平衡常数K 为。
-
(5) 丁烷一空气燃料电池以熔融的K2CO3( 其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-=26CO32- , 则负极反应式为。
2H2O2(l)=2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)=2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)的ΔH是( )


-
(1) 以
 与
与  为原料可合成尿素。已知:
为原料可合成尿素。已知:
①


②


③


写出NH3和CO2合成尿素和液态水的热化学方程式。
-
(2) 高温下,CO2与足量的碳在密闭容器中实现反应:
 。向容积为1L的恒容容器中加入0.2molCO2 , 在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2 , 达到新平衡后,体系中CO的百分含量(填“变大”、“变小”或“不变”)。
。向容积为1L的恒容容器中加入0.2molCO2 , 在不同温度下达到平衡时CO2的物质的量浓度随温度的变化如图所示。则该反应为(填“放热”或“吸热”)反应;某温度下若向该平衡体系中再通入0.2molCO2 , 达到新平衡后,体系中CO的百分含量(填“变大”、“变小”或“不变”)。

-
(3) 一定量的
 与足量的碳在体积可变的恒压密闭容器中反应:
与足量的碳在体积可变的恒压密闭容器中反应:  ,平衡时体系中气体体积分数与温度的关系如图所示:
,平衡时体系中气体体积分数与温度的关系如图所示:

①650℃时,反应达平衡后
 的转化率为。
的转化率为。②
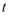 ℃时,平衡常数
℃时,平衡常数 
 (用平衡分压代替平衡浓度计算,分压
(用平衡分压代替平衡浓度计算,分压  总压
总压 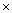 体积分数)。
体积分数)。 -
(4)
 与
与  能发生反应:
能发生反应: 
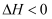
在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多次实验(各次实验的温度可能相同,也可能不同),测定
 的平衡转化率。部分实验结果如图所示:
的平衡转化率。部分实验结果如图所示:
①当容器内(填标号)不再随时间的变化而改变时,反应达到平衡状态。
A.气体的压强 B.气体的平均摩尔质量 C.气体的密度 D.
 的体积分数
的体积分数②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是。
③若A点对应实验中,
 的起始浓度为
的起始浓度为  ,经过
,经过  达到平衡状态,该时段化学反应速率
达到平衡状态,该时段化学反应速率 
 。
。④图中C、D两点对应的温度分别为
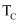 ℃和
℃和  ℃,通过计算判断
℃,通过计算判断 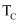
 (填“
(填“  ”、“
”、“  ”或“
”或“  ”)。
”)。
-
(1) 常温下,在不同试剂中加入酸或碱后体系pH的变化如下表所示。
试剂
pH
初始
通入0.01 mol HCl气体
加入0.01 mol NaOH固体
i.1 L H2O
7
a
12
ii.0.10 mol CH3COOH+0.10 mol CH3COONa配制成1 L的溶液
4.76
4.67
4.85
①a=(忽略通入HCl气体前后体系的体积变化)。
②结合化学用语解释试剂ii显酸性的原因:。
③试剂ii中微粒浓度关系正确的有(填序号)。
a. c(CH3COOH)>c(Na+)>c(CH3COO-)
b. 2c(H+)=c(CH3COO-)-c(CH3COOH)+2c(OH-)
c. c(CH3COOH)+c(CH3COO-)=0.2 mol/L
④由表中数据可知,试剂ii的pH受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的pH几乎不变的作用称为缓冲作用。下列溶液具有缓冲作用的是(填序号)。
a. HCl—NaCl b. Na2CO3—NaHCO3 c. NH3·H2O-NH4Cl d. KOH—KCl
-
(2) 缓冲溶液应用在某种液钒电池中能稳定电池的输出电流,该电池装置示意图如下图所示,电池的总反应如下:
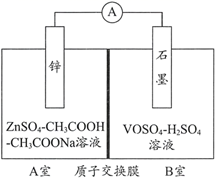
Zn+2VOSO4+2H2SO4
 ZnSO4+V2(SO4)3+2H2O
ZnSO4+V2(SO4)3+2H2O已知:VOSO4和V2(SO4)3的电离方程式分别为VOSO4=VO2++SO42-;V2(SO4)3=2V3++3SO42-;
①放电时,B室中c(H+)(填“增大”“减小”或“不变”),结合化学用语说明理由:。
②充电时,A室中的c(H+)变化缓慢的原因是。

 B . 放电过程中,电子由电极a经导线流向电极b
C . 该电池工作时,
B . 放电过程中,电子由电极a经导线流向电极b
C . 该电池工作时,  经“交换膜2”移向b极
D . H2参与的电极反应为:
经“交换膜2”移向b极
D . H2参与的电极反应为: 
-
(1) 在25 ℃、101 kPa条件下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为。
-
(2) 若适量的N2和O2完全反应生成NO2 , 每生成23 g NO2需要吸收16.95 kJ热量。则该反应的热化学方程式为。
-
(3) 用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则该反应的热化学方程式为。
-
(4) 燃烧1 g乙炔生成二氧化碳和液态水放出热量50 kJ,则表示乙炔燃烧热的热化学方程式为。
-
(5) 在25 ℃、101 kPa下,已知SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是。
-
(6) 已知4.4 g CO2气体与足量H2经催化生成CH3OH气体和水蒸气时放出4.95 kJ的热量,其热化学方程式为:。
-
(7) 已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1344.1 kJ· mol-1
2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1169.2 kJ· mol-1
由Al2O3、C和Cl2反应生成AlCl3(g)的热化学方程式为。
N2(g)+2O2(g)= 2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+ 2H2O(g) △H= -534kJ/mol
试写出气态肼(N2H4)与NO2反应生成N2(g)和气态水的热化学反应方程式:
-
(1) 4g硫粉完全燃烧生成二氧化硫气体,放出37kJ热量,热化学方程式
-
(2) 命名有机物:



 ,a电极上会生成1.5molCO2
D . 反应完毕后溶液的pH会升高
,a电极上会生成1.5molCO2
D . 反应完毕后溶液的pH会升高

①HCl(aq)+NH3·H2O (aq)=NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH=-b kJ·mol-1
③HNO3 (aq)+NaOH (aq)=NaNO3 (aq)+H2O(l) ΔH=-c kJ·mol-1
下列有关a、b、c三者的大小关系中正确的是 ( )
 在光照和点燃条件下的 △H相同
B . 氢氧化钠固体溶于水会放出大量的热量,属于放热反应
C . 反应物的总能量低于生成物的总能量时,发生放热反应
D . 吸热反应必须加热才能发生
在光照和点燃条件下的 △H相同
B . 氢氧化钠固体溶于水会放出大量的热量,属于放热反应
C . 反应物的总能量低于生成物的总能量时,发生放热反应
D . 吸热反应必须加热才能发生
①锌粒与稀H2SO4反应制取H2②氢气在氧气中燃烧③碳酸钙高温分解成氧化钙和二氧化碳④氢氧化钾和硫酸中和⑤Ba(OH)2•8H2O与NH4Cl反应⑥氢气还原氧化铜⑦葡萄糖在人体内氧化分解⑧制取水煤气的反应
 的装置如图所示。电池放电时的反应为
的装置如图所示。电池放电时的反应为 , 电解池两极材料分别为
, 电解池两极材料分别为 和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是( )
和石墨,工作一段时间后,右侧玻璃管产生大量的白色沉淀。下列说法正确的是( )
 C . 正极可发生反应:
C . 正极可发生反应: D . 锂电极减重
D . 锂电极减重 时,则电路中转移
时,则电路中转移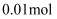 电子
电子
-
(1) 已知:Fe(s)+
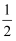 O2(g)= FeO(s) ΔH= -272.0KJ·mol-1
O2(g)= FeO(s) ΔH= -272.0KJ·mol-12Al(s)+
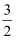 O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1
O2(s)= Al2O3(s) ΔH=-1675.7KJ·mol-1Al和FeO发热反应的热化学方程式是。
-
(2) 某可逆反应在不同条件下的反应历程分别为A、B,如图所示。

①据图判断:当反应达到平衡后,其他条件不变,升高温度,反应物的转化率(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为 (选 填序号)。
A.升高温度 B.增大反应物的浓度
C. 降低温度 D.使用催化剂
-
(3) 1000℃时,硫酸钠与氢气发生下列反应: Na2SO4(s)+4H2(g)= Na2S(s)+ 4H2O(g)。该反应的平衡常数表达式为K=;已知K (1000℃ ) <K (1200℃) ,若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、 “减小”或“不变”)。
-
(4) 常温下,如果取0.1mol·L-1HA溶液与0.1mol ·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH—浓度与0.1mol·L-1NaOH溶液中由水电离出的OH—浓度之比为;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为(填序号)>>
a.NH4Cl b. NH4A c. (NH4)2CO3


②

③

则: 的反应热
的反应热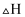 为( )
为( )
 B .
B . 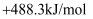 C .
C .  D .
D . 



