4.1 物质在溶解过程中有能量变化吗? 知识点题库
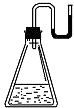
有下列物质:①NaOH固体:②浓硫酸;③NH4NO3晶体;④CaO固体.现将它们分别装入有水的锥形瓶里,立即塞紧带U形管的塞子,发现U形管内滴有红墨水的水血.呈形如图所示状态,判断加入的物质可能是( )

-
(1) 研究小组做该实验时环境温度(填“高于”、“低于”或“等于”)22℃.
-
(2) 由题干及图形可知,V1:V2=时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为mol/L
-
(3) 若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
-
(4) 请简要说明图2装置的不足之处.
 转移溶液
B .
转移溶液
B .  搅拌溶液
C .
搅拌溶液
C .  熄灭酒精灯
D .
熄灭酒精灯
D . 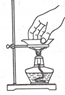 取蒸发皿
取蒸发皿
| | | | |
| A.用海水制取蒸馏水 | B.分离水和乙醇 | C.除去水中的泥沙 | D.从食盐水中获取氯化钠 |
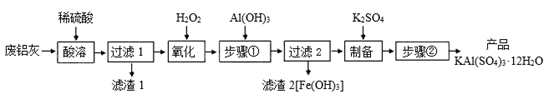
已知:Fe3+开始沉淀到沉淀完全时溶液的pH为1.9~3.7。
-
(1) 加快“酸溶”速率的措施有(列举一种即可),其中“酸溶”时,Al2O3溶解的化学方程式为。
-
(2) “氧化”时,发生反应的离子方程式为。
-
(3) “步骤①”的目的是;检验“ 过滤2”滤液中是否含Fe3+可用试剂。
-
(4) “步骤②”包含的操作有、、过滤及干燥。
-
(1) 已知两种同素异形体A、B的燃烧热的热化学方程式为:
A(s)+O2(g)═CO2(g)△H=﹣393.51 kJ•mol﹣1
B(s)+O2(g)=CO2(g)△H=﹣395.41 kJ•mol﹣1
则两种同素异形体中较稳定的是(填“A”或“B”)。
-
(2) 工业上用H2和Cl2反应制HCl,各键能数据为:H﹣H:436kJ/mol,Cl﹣Cl:243kJ/mol,H﹣Cl:431kJ/mol。该反应的热化学方程式是。
-
(3) 合成气(CO和H2为主的混合气体)不但是重要的燃料也是重要的化工原料,制备合成气的方法有多种,用甲烷制备合成气的反应为:
①2CH4(g)+O2(g)═2CO(g)+4H2(g);△H1=﹣72kJ•mol﹣1
②CH4(g)+H2O(g)═CO(g)+3H2(g);△H2=+216kJ•mol﹣1
氢气与氧气反应生成水蒸气的热化学方程式为。现有1mol由H2O(g)与O2组成的混合气,且O2的体积分数为x,将此混合气与足量CH4充分反应.
若x=0.2时,反应①放出的能量为kJ;
若x=时,反应①与②放出(或吸收)的总能量为0。
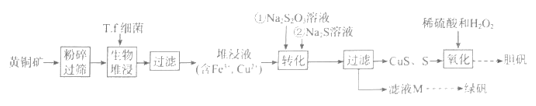
已知:①T.f细菌在1.0<pH<6.0范围内保持生物活性。
②几种离子形成氢氧化物沉淀的pH如表所示:
|
Fe3+ |
Fe2+ |
Cu2+ |
|
|
开始沉淀时的pH |
1.9 |
7.0 |
4.2 |
|
完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
回答下列问题:
-
(1) 从物质分类的角度看,本题中涉及的“矾”属于 (填序号)。
A.化合物 B.硫酸盐 C.混合物 D.复盐
为了提高生物堆浸速率,上述流程采用的措施是。
-
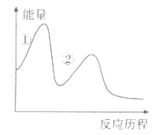
(2) 生物堆浸包括两个过程:
①CuFeS2+4H++O2=Cu2++Fe2++2S+2H2O;②(补充离子方程式)。
这两个过程中的能量变化如图所示,其中控制生物堆浸总速率的是 (填“①”或“②")。生物堆浸过程中应控制溶液pH的范围为。
-
(3) 检验滤液M中是否含硫酸铁的试剂为(填化学式)。在确定无Fe3+后,滤液M先加入少量稀硫酸,目的是。然后经过、洗涤、干燥制得绿矾。
-
(4) 测定绿矾(FeSO4·7H2O,式量为278)样品的纯度。取wg绿矾样品溶于稀硫酸中,配制成100 mL溶液。取25.00 mL配制溶液于锥形瓶中,将c mol·L-1标准KMnO4溶液装入(填酸式、碱式)滴定管进行滴定至终点,三次平行实验所消耗溶液体积依次为25.00mL、24.95mL、25.05mL,该绿矾样品的纯度为(用含w、c的代数式表示)。

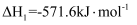
②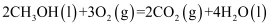
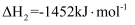
③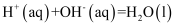

下列说法正确的是( )
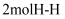 和
和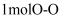 的键能总和比
的键能总和比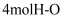 的键能大
B .
的键能大
B .  的燃烧热为
的燃烧热为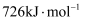 C . 同质量的
C . 同质量的 和
和 完全燃烧,
完全燃烧, 放出的热量多
D .
放出的热量多
D . 
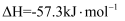
I.Cl2(g)→2Cl·(g)
II.CH3CH2CH3(g)+Cl·(g)→ (g)+HCl(g)
(g)+HCl(g)
III. (g)+Cl2(g)→CH3CHClCH3(g)+Cl·(g)
(g)+Cl2(g)→CH3CHClCH3(g)+Cl·(g)
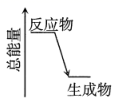
其中,II步反应为决速步骤,能量随反应进程的变化如图,下列说法错误的是( )
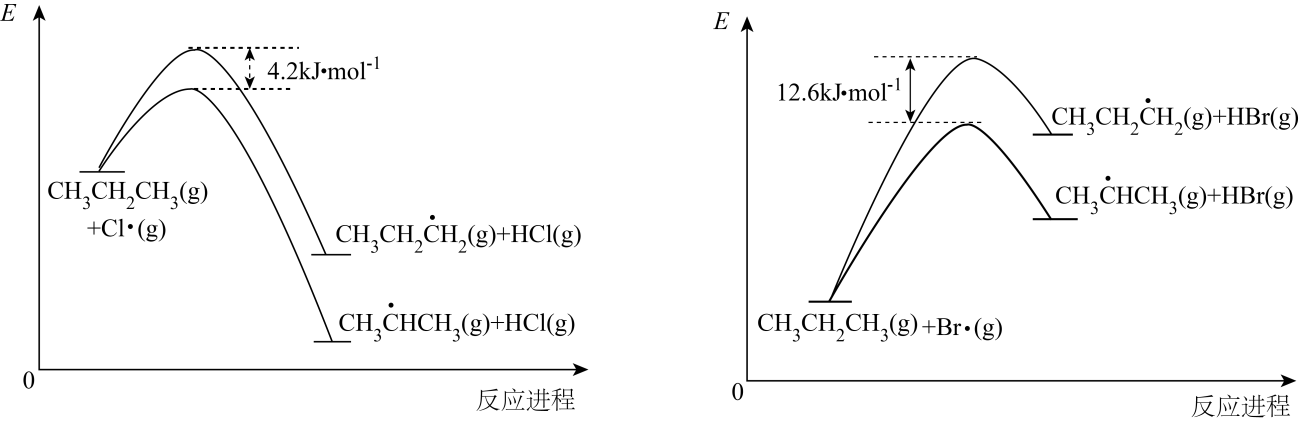
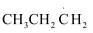 小于
小于 C . 丙烷中不同基团上碳氢键断裂吸收的能量不同
D . 丙烷氯代产物中
C . 丙烷中不同基团上碳氢键断裂吸收的能量不同
D . 丙烷氯代产物中 与溴代产物中
与溴代产物中 近似相等
近似相等
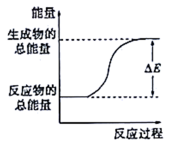
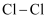 )时会吸收能量
D . 灼热的炭粉与二氧化碳反应能量变化符合题图
)时会吸收能量
D . 灼热的炭粉与二氧化碳反应能量变化符合题图
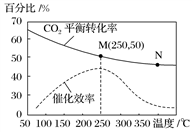
 CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )
CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法错误的是( )