4.2 化学变化中的能量变化 知识点题库

-
(1) 已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol−1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH=kJ·mol−1。
-
(2) 一定温度下,向容积为1L的密闭容器中充入一定量的NO和CO。在t1时刻达到平衡状态,此时n(CO)=0.1mol,n(NO)=0.2mol,n(N2)=a mol,且平衡时混合气体压强为初始气体压强的0.8。
①则该反应的平衡常数K=。若保持温度及容器容积不变,平衡后在此基础上再向容器中充入2a mol的N2、0.2mol的NO,平衡将(填“向左”“向右”或“不”)移动。
②下列各种情况,可说明该反应已经达到平衡状态的是(填字母)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.NO、CO、N2、CO2的浓度均不再变化
E.单位时间内生成2n mol碳氧双键的同时消耗n mol N≡N
③在t2时刻,改变某一外界条件,正反应速率的变化曲线如图所示:可能改变的条件是

-
(3) 有人提出可以用如图所示的电解原理的方法消除汽车尾气,写出阳极发生的电极反应式:。
-
(4) 如果要净化汽车尾气同时提高该反应的速率和NO的转化率,采用的措施是____。A . 降低温度 B . 增大压强同时加催化剂 C . 升高温度同时充入N2 D . 及时将CO2和N2从反应体系中移走
-
(1) 在一定条件下,氮气能和水蒸气反应生成氨气和氧气2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H,与该反应相关的化学键键能数据如下:
化学键
N≡N
H—O
N—H
O=O
E(kJ/mol)
946
463
391
496
则该反应的△H=kJ·mol-1。
-
(2) 在恒容密闭容器中充入2 mol N2O5与1molO2发生反应4NO2 (g) + O2 (g)
 2N2O5 (g) △H。
2N2O5 (g) △H。 ①已知在不同温度下测得N2O5的物质的量随时间的变化如图所示,该反应的△H0(填“>”“<”或“=”)。高温下该反应能逆向自发进行,其原因是。
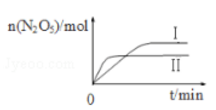
②下列有关该反应的说法正确的是(填标号)。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2 mol NO2和1molO2 , 再次达到平衡时,NO2的转化率增大
C.恒温恒容,当容器内的密度保持不变时,反应达到了平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
-
(3) N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5 , 工作原理如图所示。则硼氢化钠燃料电池的负极反应式为。

-
(4) X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01mol・L—1的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为。
0.01mol・L—1的溶液
X
Y
Z
W
pH
12
2
8.5
4.5
-
(5) 氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)
 NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1Ⅱ:2NO(g)+Cl2 (g)
 2CNO(g) K2
2CNO(g) K2①4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示)。②在恒温条件下,向2L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2 , 10min时反应Ⅱ达到平衡,测得10min内v(ClNO)=7.5×10-3mol・L-1・min-1 , 则平衡时NO的转化率α1=;若其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”)。
-
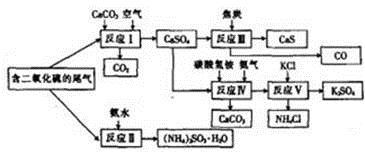
(1) 写出反应Ⅲ的化学方程式:。
-
(2) 下列有关说法正确的是_________(填字母)A . 反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 B . 反应Ⅱ和反应Ⅲ的基本反应类型相同 C . 反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 D . 反应Ⅴ中的副产物氯化铵可用作氮肥
-
(3) (NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:。
-
(4) 很多硫酸厂为回收利用SO2 , 直接用氨水吸收法处理尾气。
①用15.0 mL 2.0 mol/L氨水吸收标准状况下448 mL SO2 , 吸收液中的溶质为。
②某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25.00mL,则酸性KMnO4溶液中c(KMnO4) =。
-
(5) 氨气用途广泛,可以直接用于燃料电池,下图是用氨水作原料的燃料电池的工作原理。
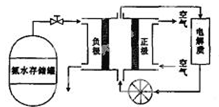
氨气燃料电池的电解质溶液最好选择(填“酸性”、“碱性”或“中性”)溶液,氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式是,负极的电极反应式是。
 使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用
使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 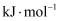 表示
表示  请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题. 
-
(1) 图中所示反应是
 填“吸热”或“放热”
填“吸热”或“放热”  反应.
反应.
-
(2) 已知拆开1mol
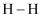 键、1mol
键、1mol  、1mol
、1mol  键分别需要吸收的能量为436kJ、151kJ、
键分别需要吸收的能量为436kJ、151kJ、  则由1mol氢气和1mol 碘反应生成HI会
则由1mol氢气和1mol 碘反应生成HI会  填“放出”或“吸收”
填“放出”或“吸收”  kJ的热量
kJ的热量  在化学反应过程中,是将转化为.
在化学反应过程中,是将转化为.
-
(3) 下列反应中,属于放热反应的是,属于吸热反应的是.
 物质燃烧
物质燃烧 炸药爆炸
炸药爆炸 酸碱中和反应
酸碱中和反应 二氧化碳通过炽热的碳
二氧化碳通过炽热的碳 食物因氧化而腐败
食物因氧化而腐败 与
与  反应
反应 铁粉与稀盐酸反应.
铁粉与稀盐酸反应.

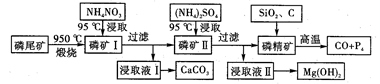
已知:①Ca5(PO4)3F在950℃不分解
②4Ca5(PO4)3F+18SiO2+30C  2CaF2+30CO↑+18CaSiO3+3P4
2CaF2+30CO↑+18CaSiO3+3P4
请回答下列问题:
-
(1) 950℃煅烧磷尾矿生成气体的主要成分是
-
(2) 实验室过滤所需的玻璃仪器是
-
(3) NH4NO3溶液能从磷矿Ⅰ中浸取出Ca2+的原因是
-
(4) 在浸取溶液Ⅱ中通入NH3 , 发生反应的化学方程式是
-
(5) 工业上通常用磷精矿[Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+3H2SO4(l)+HF(g)=5H2O(l)+Ca5(PO4)3F(s) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是
-
(1) 已知:①N2(g)+O2(g)
 2NO(g) ΔH=+180.5kJ/mol;
2NO(g) ΔH=+180.5kJ/mol; ②CO的燃烧热为283.0kJ/mol。
则2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH=kJ/mol。
N2(g)+2CO2(g) ΔH=kJ/mol。 -
(2) 在恒温、恒容条件下,将2.0mol NO和1.0mol CO充入一个容积为2L的密闭容器中发生上述反应,反应过程中部分物质的物质的量(n)变化如图所示。

①N2在0~9min内的平均反应速率v(N2)=mol/(L·min);
②第9min时氮气的产率为;
③第12min时改变的反应条件可能为(填字母代号);
A.升高温度 B.加入NO C.加催化剂 D.减小压强 E.降低温度
④若在第24min将NO与N2的浓度同时增加到原来的2倍,化学平衡移动(填“向正反应方向”、“逆反应方向”或“不”)。
-
(3) 若将反应容器改为恒温容积可变的恒压密闭容器,压强为P=3.0MPa,反应物加入的物质的量不变,达到平衡时CO的转化率为50%,该温度下此反应平衡常数Kp=。


 O2(g)=2CO2(g)+H2O(l) ΔH=b kJ·mol-1
C . C2H2(g)+
O2(g)=2CO2(g)+H2O(l) ΔH=b kJ·mol-1
C . C2H2(g)+ 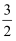 O2(g)= 2CO(g)+H2O(g) ΔH=c kJ·mol-1
D . C2H2(g)+
O2(g)= 2CO(g)+H2O(g) ΔH=c kJ·mol-1
D . C2H2(g)+ 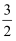 O2(g)=2CO(g)+H2O(l) ΔH=d kJ·mol-1
O2(g)=2CO(g)+H2O(l) ΔH=d kJ·mol-1
-
(1) Ⅰ.研究温度对
 催化H2O2分解速率的影响
催化H2O2分解速率的影响 H2O2分解时,温度会明显上升,表明反应物总能量于生成物总能量。(填“高”或“低”)
-
(2) 按图1组装仪器,在试管中加入过氧化氢和蒸馏水,在恒温水浴中浸泡2min后,加入CuSO4溶液。实验记录和数据处理见表1。
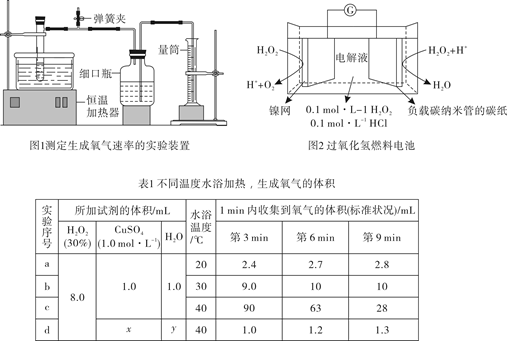
①必须使用恒温水浴的原因是。
②实验c的第9min,生成O2物质的量为mmol(1mmol=10-3mol),H2O2的平均反应速率为v(H2O2)=
 。
。③由实验a、b、c可知,升温加快O2生成。为确认升温时加快了H2O2自身分解还是加强了Cu2+的催化效果,需进一步开展实验d,其中x=,y=,结果表明后者成立。
-
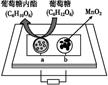
(3) Ⅱ.研究过氧化氢燃料电池
一种过氧化氢燃料电池装置如图2。
①“负载碳纳米管的碳纸”作极(填“正”或“负”),发生反应(填“氧化”或“还原”),补全其电极反应式:H2O2+2H++=2H2O。
②电子的流向为(填选项序号)。
a.镍网→外电路→碳纸 b.碳纸→外电路→镍网
c.碳纸→溶液→镍网 d.镍网→溶液→碳纸
③碳纳米管是理想的电极材料,以下说法不属于其优点的是(填选项序号)
A.化学性质活泼 B.导电性强 C.耐腐蚀 D.催化性能好 E.表面积大
-
(4) 与利用化学反应放出的热量相比,利用燃料电池供能的显著优势是。
 2CO(g)+2H2(g)。回答下列问题:
2CO(g)+2H2(g)。回答下列问题:
-
(1) 已知相关物质的燃烧热(25℃、101kPa):
物质
CH4(g)
CO(g)
H2(g)
燃烧热(ΔH/kJ·mol-1)
-890.3
-283.0
-285.8
则CH4—CO2催化重整反应的ΔH=kJ·mol-1。
-
(2) 将原料按初始组成n(CH4):n(CO2)=1:1充入密闭容器中,保持体系压强为100kPa发生反应,达到平衡时CO2体积分数与温度的关系如图所示。

①T1℃、100kPa下,n(平衡时气体):n(初始气体)=;该温度下,此反应的平衡常数Kp=(kPa)2(以分压表示,列出计算式)。
②若A、B、C三点表示不同温度和压强下已达平衡时CO2的体积分数,点对应的平衡常数最小,理由是;点对应压强最大,理由是。
-
(3) 900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)
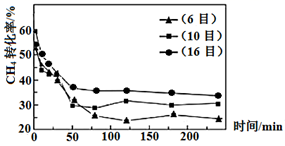
由图可知,75min后CH4转化率与炭催化剂目数的关系为,原因是。
-
(1) 写出实验室用
 溶液制取
溶液制取 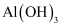 沉淀的离子方程式: 。
沉淀的离子方程式: 。
-
(2) 浓硝酸应贮存在避光低温处,原因是:(用化学方程式表示)。
-
(3) 乙烷气体(
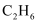 )的标准燃烧热
)的标准燃烧热  ,则乙烷气体燃烧的热化学方程式可表示为:。
,则乙烷气体燃烧的热化学方程式可表示为:。

 B . 放电时,电路中转移的电子数等于N区增加的离子数
C . 充电时,a极为阴极,接电源的负极
D . 若将a极的Zn换成Li,电池可正常工作,且比能量更高
B . 放电时,电路中转移的电子数等于N区增加的离子数
C . 充电时,a极为阴极,接电源的负极
D . 若将a极的Zn换成Li,电池可正常工作,且比能量更高


 B .
B . 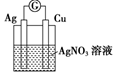 C .
C . 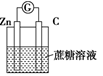 D .
D . 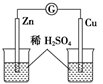
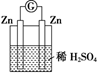
 , 下列叙述错误的是( )
, 下列叙述错误的是( )
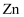 和
和 的总能量大于
的总能量大于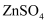 和
和 的总能量
B . 反应过程中能量关系可用图表示
C . 若将该反应设计成原电池,则
的总能量
B . 反应过程中能量关系可用图表示
C . 若将该反应设计成原电池,则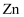 为负极
D . 若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体(标准状况)
为负极
D . 若将该反应设计成原电池,当有65g锌溶解时,正极放出11.2L气体(标准状况)



