4.2 化学变化中的能量变化 知识点题库

-
(1) B元素在周期表中的位置为。
-
(2) 由A,C,D三种元素组成的化合物的电子式为。
-
(3) 废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式。
-
(4) 若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为。(氧化产物不污染环境)
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答以下问题:
-
(1) 若25<t1<t2 , 则α(填“<”“>”或“=”)1×10-14 , 作出此判断的理由是。
-
(2) t1℃下,将pH=a的苛性钠溶液10mL与pH=b的稀硫酸500mL混合,测得溶液呈中性,若a+b=14 , 则此温度下水的离子积常数α=。
-
(3) t2 ℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=10,则V1∶V2=。

 2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是( )
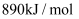 ,但当
,但当 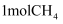 不完全燃烧生成CO和
不完全燃烧生成CO和  时,放出的热量为607kJ,如果
时,放出的热量为607kJ,如果 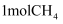 与一定量
与一定量  燃烧生成CO、
燃烧生成CO、  、
、  ,并放出
,并放出  的热量,则一定量
的热量,则一定量  的质量为
的质量为 

 CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。
CH3OH(g)。在容积均为1L的a、b、c、d、e五个密闭容器中分别充入等量的1mol CO和2mol H2混合气体,控温。实验测得相关数据如下图1和图2。 
下列有关说法正确的是( )
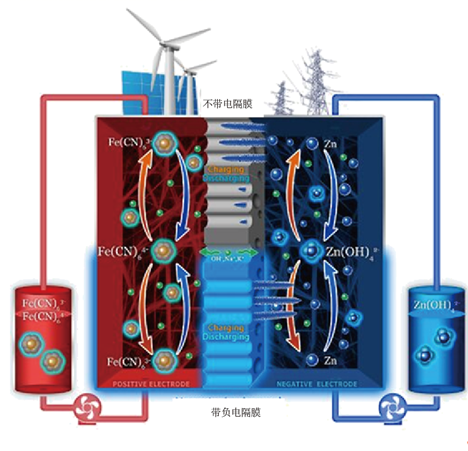
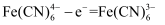 B . 充电时,b电极区pH增大
C . 理论上,每消耗6.5gZn,溶液中将增加0.1
B . 充电时,b电极区pH增大
C . 理论上,每消耗6.5gZn,溶液中将增加0.1 
 D . 采用带负电隔膜可减少充电时产生锌枝晶破坏隔膜
D . 采用带负电隔膜可减少充电时产生锌枝晶破坏隔膜
下列说法错误的是( )



 从右边穿过离子交换膜向左边移动
D . 正极的电极反应是
从右边穿过离子交换膜向左边移动
D . 正极的电极反应是 
①CH2=CH-CH=CH2(g)+Br2(g)→ ![]() (g) △H1=akJ·mol-1
(g) △H1=akJ·mol-1
②CH2=CH-CH=CH2(g)+Br2(g)→  (g) △H2=bkJ·mol-1
(g) △H2=bkJ·mol-1
③ ![]() (g)⇌
(g)⇌  (g) △H3
(g) △H3
回答下列问题:
-
(1) △H3=。
-
(2) 1,3-丁二烯和Br2反应的能量随反应过程的变化关系如图所示:

1,3-丁二烯和Br2反应会生成两种产物,一种称为动力学产物,由速率更快的反应生成;一种称为热力学产物,由产物更加稳定的反应生成。则动力学产物结构简式为
-
(3) T℃时在2L刚性密闭容器中充入1,3-丁二烯(g)(CH2=CH-CH=CH2)和Br2(g)各2mol,发生反应。1,3-丁二烯及产物的物质的量分数随时间的变化如下表:
时间(min)
0
10
20
30
40
1,3-丁二烯
100%
72%
0%
0%
0%
1,2加成产物
0%
26%
10%
4%
4%
1,4加成产物
0%
2%
90%
96%
96%
在0 ~20min内,反应体系中1,4-加成产物的平均反应速率v(1,4加成产物)=。
-
(4) 对于反应③,若要提高1,4-加成产物 (
 )平衡体系中的物质量分数,可以采取的措施有_____
A . 适当升高温度 B . 使用合适的催化剂 C . 增大体系的压强 D . 将1,4加成产物及时从体系分离
)平衡体系中的物质量分数,可以采取的措施有_____
A . 适当升高温度 B . 使用合适的催化剂 C . 增大体系的压强 D . 将1,4加成产物及时从体系分离 -
(5) 反应 1,3-丁二烯二聚体的解聚为可逆反应:
 (g)
(g)  2
2  (g) △H>0
(g) △H>0在一定条件下,C4H6和C8H12的消耗速率与各自分压有如下关系:v(C8H12)=k1·p(C8H12),v(C4H6)=k2·p2(C4H6)。相应的速率与其分压关系如图所示,一定温度下k1、k2与平衡常数Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系是k1=;在图中标出点(A、B、C、D)中,能表示反应达到平衡状态的点是 ,理由是。

-
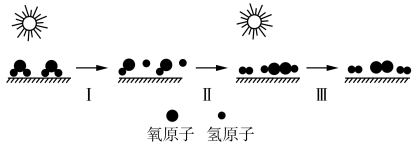
(1) Ⅰ.将打磨后的镁条放入锥形瓶中,再将注射器中某浓度的盐酸压入锥形瓶中,通过数字传感器测定实验中密闭容器(气密性良好)内压强与时间的关系如图2所示。
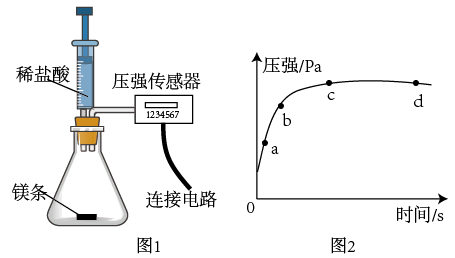
镁条与盐酸反应的离子方程式为。该反应为 (填“吸热”或“放热”)反应。
-
(2) 图2中a、b、c、d四个点中,产生氢气最快的为点。
-
(3) 图中c点镁条已完全溶解,cd段容器内压强逐渐减小的原因可能是。
-
(4) Ⅱ.向恒温恒容的密闭容器中,加入足量的碳和一定量NO,发生如下反应

 ,数字传感器测得
,数字传感器测得  浓度随时间变化如表:
浓度随时间变化如表: 反应时间/s
0
80
90
100
110
 浓度/
浓度/ 
0.00
0.30
0.32
0.33
0.33
若该反应在t s时恰好到达平衡,t所在时间段可能为___________
A . 0s<t<80s B . 80s≤t<90s C . 90s<t<100s D . 100s≤t<110s -
(5) 0〜80s用NO来表示反应的速率为
-
(6) 下列能说明反应达到平衡状态是___________A .
 B . 容器内压强不再改变
C .
B . 容器内压强不再改变
C .  D .
D .  的体积分数不再改变
的体积分数不再改变 已知:反应体系中
 的体积分数
的体积分数 
-
(1) 某化工厂排出的尾气(含CO、N2O)治理的方法为:在密闭容器中发生如下反应:CO(g) + N2O(g)
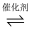 CO2(g) + N2(g),CO、N2O 在Pt2O+表面进行两步反应转化为无毒气体,其相对能量与反应历程的关系如下图。
CO2(g) + N2(g),CO、N2O 在Pt2O+表面进行两步反应转化为无毒气体,其相对能量与反应历程的关系如下图。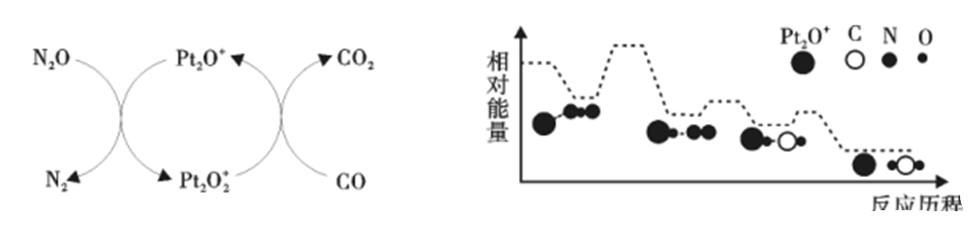
①写出N2O在Pt2O+的表面上反应的化学方程式。
②第一步反应的速率比第二步的( 填“ 慢”或“快”)。两步反应均为热反应。
-
(2) 汽车尾气中含NO,处理NO的一种方法为: 2 CO(g) +2 NO(g)
 N2(g) +2 CO2(g)
N2(g) +2 CO2(g)①已知该反应为自发反应,则该反应的反应热△H 0. (选填“>”或“<”或“=”)
②一定温度下,将2 mol CO、4 mol NO充入一恒压密闭容器。已知起始压强为11 MPa,达到平衡时,测得N2的物质的量为0. 5 mol ,则该温度此反应用平衡分压代替平衡浓度的平衡常数Kp=MPa -1(分压=总压×物质的量分数)。
-
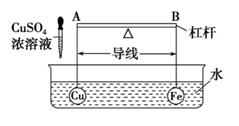
(3) 2021年3月5日,国务院政府工作报告中指出,扎实做好碳达峰碳中和各项工作。科研工作者通过开发新型催化剂,利用太阳能电池将工业排放的CO2 转化为HCOOH,实现碳中和的目标。如图所示:

①离子交换膜为离子交换膜。
②P极电极反应式为。
③工业上利用甲酸的能量关系转换图如图所示:

反应CO2(g) + H2(g)
 HCOOH(g)的焓变△H =kJ·mol-1。温度为T1℃时,将等物质的量的CO2和H2充入体积为1 L的密闭容器中发生反应:CO2(g)+H2(g)
HCOOH(g)的焓变△H =kJ·mol-1。温度为T1℃时,将等物质的量的CO2和H2充入体积为1 L的密闭容器中发生反应:CO2(g)+H2(g)  HCOOH(g) K=2。 实验测得:v正=k正c(CO2)c(H2), v逆=k逆c(HCOOH), k正、k逆为速率常数。T1℃时,k逆= k正 ;温度为T2℃时,k正=1. 9k逆 , 则T2℃> T1℃,理由是。
HCOOH(g) K=2。 实验测得:v正=k正c(CO2)c(H2), v逆=k逆c(HCOOH), k正、k逆为速率常数。T1℃时,k逆= k正 ;温度为T2℃时,k正=1. 9k逆 , 则T2℃> T1℃,理由是。

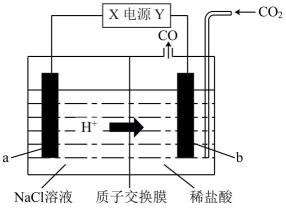
 CO + NaClO。a、b均为涂装催化剂的惰性电极。下列说法错误的是( )
CO + NaClO。a、b均为涂装催化剂的惰性电极。下列说法错误的是( )