4.2 化学变化中的能量变化 知识点题库

请回答:
Ⅰ.用如图1所示装置进行第一组实验.
-
(1) 在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号).A . 铝. B . 石墨 C . 银 D . 铂
-
(2) M极发生反应的电极反应式为;
-
(3) 实验过程中,SO42﹣(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有,写出产生此现象的反应方程式:;
-
(4) Ⅱ.用如图2所示装置进行第二组实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42﹣)在溶液中呈紫红色.
电解过程中,X极区溶液的pH(填“增大”、“减小”或“不变”);
-
(5) 电解过程中,Y极发生的电极反应为Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O 和 4OH﹣﹣4e﹣═2H2O+O2↑,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g.
-
(6) 在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应为:2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 该电池正极的电极反应式为.
 B .
B .  C .
C .  D .
D . 
-
(1) 向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是。
-
(2) 选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是。
-
(3) 以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO42−、NO3− , 均为放热反应。
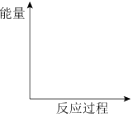
①在如图中画出“放热反应”的反应过程中的能量变化示意图 。
②NaClO溶液吸收烟气中SO2的离子方程式是。
③一定时间内,温度对硫、硝脱除率的影响曲线如图,SO2的脱除率高于NO,可能的原因是(写出1种即可)。

④烟气中SO2和NO的体积比为4∶1,50℃时的脱除率见图2,则此吸收液中烟气转化生成的NO3−和Cl−的物质的量之比为。
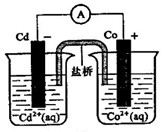

 C . 2Ag+(aq)+Cd(s)= 2Ag(s)+Cd2+(aq)
D .
C . 2Ag+(aq)+Cd(s)= 2Ag(s)+Cd2+(aq)
D . 

 的酸性废水,最终可将
的酸性废水,最终可将  转化成
转化成  沉淀而除去,装置如下图。下列说法正确的是( )
沉淀而除去,装置如下图。下列说法正确的是( ) 
 为阳极
B . M电极的电极反应式为
为阳极
B . M电极的电极反应式为  C . 电解一段时间后,在
C . 电解一段时间后,在 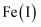 极附近有沉淀析出
D . 电路中每转移6mol电子,最多有1mol
极附近有沉淀析出
D . 电路中每转移6mol电子,最多有1mol  被还原
被还原
 CO(g)+2H2(g) ∆H,能量变化情况如图。下列叙述正确的是( )
CO(g)+2H2(g) ∆H,能量变化情况如图。下列叙述正确的是( ) 
-
(1) 从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要(填“吸收”或“放出”)能量,能量变化值的大小△E=(用E反和E生表示)
-
(2) 从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=KJ;形成生成物中的化学键放出的总能量为=KJ。E吸E放(填“>”或“<”),所以该反应要(填“吸收”或“放出”)能量,能量变化值的大小△E=KJ(填数值)
-
(3) 由图可知,化学反应的本质是化学反应中能量变化的主要原因是(从总能量说明)


-
(1) 已知,在
 时:
时: i:

ii:

①写出
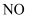 与
与  反应生成两种无毒气体的热化学方程式。
反应生成两种无毒气体的热化学方程式。②请根据以上相关数据,分析仅使用催化剂能否有效消除
 尾气污染(要求写出分析过程)。
尾气污染(要求写出分析过程)。 -
(2) 如用
 催化还原
催化还原  可以消除氮氧化物的污染,发生的反应如下:
可以消除氮氧化物的污染,发生的反应如下: 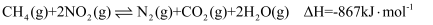 。
。 ①下列有关说法正确的是(填字母)。
A.在容器中充入
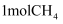 和
和  ,当体系
,当体系  比值不随时间变化时,反应达到平衡状态
比值不随时间变化时,反应达到平衡状态B.恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.恒温恒压时,充入
 有利于提高氮氧化物的转化率
有利于提高氮氧化物的转化率②在
 时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,
时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,  时刻达到新的平衡状态。请在图中画出从
时刻达到新的平衡状态。请在图中画出从  到
到  时刻
时刻  随时间的变化曲线。
随时间的变化曲线。
-
(3) 用
 催化还原
催化还原  也可以消除氮氧化物的污染,其反应原理为:
也可以消除氮氧化物的污染,其反应原理为:  。试写出该反应平衡常数的表达式
。试写出该反应平衡常数的表达式  [用各组分的平衡分压表示,如
[用各组分的平衡分压表示,如  为
为  的平衡分压]。
的平衡分压]。
-
(4) 用间接电化学法对大气污染物
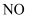 进行无害化处理,其原理示意如图(质子膜允许
进行无害化处理,其原理示意如图(质子膜允许 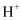 和
和  通过),电极
通过),电极 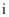 上的反应式为。
上的反应式为。 
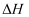 =+80 kJ·mol-1能自发进行,原因是体系有自发向混乱度增大的方向转变的倾向
=+80 kJ·mol-1能自发进行,原因是体系有自发向混乱度增大的方向转变的倾向
 H<0
B . 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C . 0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D . 蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
H<0
B . 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应
C . 0.1mol·L-1Na2CO3溶液在50℃时的碱性比25℃强,说明盐类水解反应是放热反应
D . 蒸发FeCl3溶液,所得固体在坩埚中充分加热,最后得到Fe2O3固体
-
(1) Ⅰ.最近几年,我国北方不少城市居民“谈霾色变”,汽车尾气是雾霾的罪魁之一。汽车尾气净化的原理为:2CO(g)+2NO(g)=2CO2(g)+N2(g) △H=-746.5kJ•mol-1。
已知N2(g)+O2(g)
 2NO(g) △H=+180.5kJ•mol-1 , 则表示CO燃烧热的热化学方程式为。
2NO(g) △H=+180.5kJ•mol-1 , 则表示CO燃烧热的热化学方程式为。 -
(2) 某温度下,在恒容的密闭容器中通入NO和CO,测得不同时间的NO和CO的浓度如表:
时间/s
0
1
2
3
4
5
c(NO)/×10-3mol•L-1
1.00
0.45
0.25
0.15
0.10
0.10
c(CO)/×10-3mol•L-1
3.60
3.05
2.85
2.75
2.70
2.70
①0~2s内用N2表示的化学反应速率为。该温度下,CO的平衡转化率为。
②实验测得,该反应的反应历程如图,其中活化能相对较大的是第步(填“一”或“二”)。
第一步:
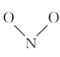 +C—O→
+C—O→ 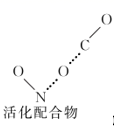 (慢反应)
(慢反应)第二步:
 →N—O+C—O—C(快反应)
→N—O+C—O—C(快反应) -
(3) 某研究小组在实验室以耐高温试剂Ag—ZSW—5催化,测得NO在有无CO的条件下转化为N2的转化率随温度变化情况如图所示:

在
 =1条件下,选择温度控制在870K的理由是。
=1条件下,选择温度控制在870K的理由是。 -
(4) 一定温度下,在恒容反应器中发生如下反应:CO(g)+NO2(g)=CO2(g)+NO(g),化学反应速率v=kpm(CO)pn(NO2)(k为化学反应速率常数,只与温度有关)。实验测得该温度下反应物的分压与化学反应速率的关系如表所示:
P(CO)/kPa
v/kPa•s-1
P(NO2)/kPa
10
20
30
10
0.009
0.018
0.027
20
0.018
0.036
0.054
30
0.027
0.054
0.081
若反应初始时p(CO)=p(NO2)akPa,达到平衡,测得体系中p(NO)=bkPa,则此时v=kPa•s-1(用含有a和b的代数式表示)。
-
(5) Ⅱ.CO、CO2在现代工业上作用越来越明显。
一定温度下,向一固定体积的密闭容器中充入CO、CO2和H2来制备甲醇。测得在不同温度下的化学反应平衡常数如表所示:
化学反应
平衡常数
温度/℃
500
700
800
①2H2(g)+CO(g)
 CH3OH(g)
CH3OH(g)K1
2.5
0.34
0.15
②H2(g)+CO2(g)
 H2O(g)+CO(g)
H2O(g)+CO(g)K2
1.0
1.70
2.52
③3H2(g)+CO2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)K3
反应②中的△H=0(填“大于”或“小于”),K3=(用K1、K2表示)
-
(6) 研究反应①在不同温度、压强下按照相同的物质的量投料反应,测得CO平衡转化率变化如图所示。下列说法正确的是___(填标号)。
 A . 温度:T1>T2>T3 B . 正反应速率:v(a)>v(c),v(b)>v(d) C . 平衡常数:K(a)>K(c),K(b)=K(d)
A . 温度:T1>T2>T3 B . 正反应速率:v(a)>v(c),v(b)>v(d) C . 平衡常数:K(a)>K(c),K(b)=K(d)
 转化率随温度变化如图。无CO时反应(I)
转化率随温度变化如图。无CO时反应(I)  ;有CO时反应(II)
;有CO时反应(II) 
 。下列有关说法错误的是( )
。下列有关说法错误的是( ) 
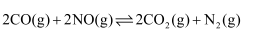 的
的  B . 催化剂对反应(II)的影响大于反应(I)
C . X点可以通过更换高效催化剂可提高NO的平衡转化率
D . 温度高于900℃后,反应(II)的曲线可能出现剧烈下降的趋势
B . 催化剂对反应(II)的影响大于反应(I)
C . X点可以通过更换高效催化剂可提高NO的平衡转化率
D . 温度高于900℃后,反应(II)的曲线可能出现剧烈下降的趋势
-
(1) 氮的固定有利于生物吸收氮.下列属于氮的固定的是(填序号).
①工业上N2和H2合成NH3 ②N2和O2放电条件下生成NO ③NH3催化氧化生成NO
写出反应③的化学方程式.
-
(2) 治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2 , 然后用水或碱液吸收脱氮.下列物质可以用作氧化NO的是(填序号).
A.NaCl溶液 B.NaOH溶液 C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥法标出反应中电子的得失和数目.
-
(3) CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如下:

①过程Ⅰ为过程(填“吸热”或“放热”)。过程Ⅱ生成的化学键有(填“极性键”、“非极性键”或“极性键和非极性键”)
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为。

 先被脱尽
D . 开始时ClO-浓度增长较慢的原因一定是被Cl-还原
先被脱尽
D . 开始时ClO-浓度增长较慢的原因一定是被Cl-还原
-
(1) NH3还原法。
研究发现NH3还原NO的反应历程如图1。下列说法正确的是____(填标号)。
 A . Fe3+能降低总反应的活化能,提高反应速率 B . 总反应为6NO+4NH3=5N2+6H2O C . 该反应历程中形成了非极性键和极性键
A . Fe3+能降低总反应的活化能,提高反应速率 B . 总反应为6NO+4NH3=5N2+6H2O C . 该反应历程中形成了非极性键和极性键 -
(2) 已知有关反应如下:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH2=+172.5kJ·mol-1
③NO和CO反应的能量变化如图2所示。

2NO(g)=N2(g)+O2(g) ΔH=kJ·mol-1。
-
(3) H2还原法。
已知催化剂Rh表面H2催化还原NO的反应机理如表所示,其他条件一定时,决定H2的催化还原NO反应速率的基元反应为(填序号)。
序号
基元反应
活化能Ea/(kJ·mol-1)
①
H2(g)+Rh(s)+Rh(s)=H(s)+H(s)
12.6
②
2NO(g)+Rh(s)=2NO(s)
0.0
③
NO(s)+Rh(s)=N(s)+O(s)
97.5
④
H(s)+O(s)=OH(s)+Rh(s)
83.7
⑤
HO(s)+H(s)=H2O(s)+Rh(s)
33.5
⑥
H2O(s)=H2O(g)+Rh(s)
45.0
⑦
N(s)+N(s)=N2(s)+Rh(s)+Rh(s)
120.9
注明:N2(s)表示N2被吸附在Rh表面上。
-
(4) CO还原法。
一定温度下,在刚性密闭容器中充入1molNO(g)和1molCO(g)发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率(“增大”、“减小”或“不变”,下同),气体总压强。
N2(g)+2CO2(g)。达到平衡后,再充入amolNO(g)和amolCO(g),NO的平衡转化率(“增大”、“减小”或“不变”,下同),气体总压强。 -
(5) 甲烷还原法。
一定温度下,在2.0L刚性密闭容器中充入1molCH4和2molNO2 , 发生反应:CH4(g)+2NO2(g)
 CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。
CO2(g)+N2(g)+2H2O(g)。测得反应时间(t)与容器内气体总压强(p)的变化如表所示。反应时间(t)/min
0
2
4
6
8
10
p/(100kPa)
4.80
5.44
5.76
5.92
6.00
6.00
达到平衡时,NO2的转化率为。若起始时加入3molCH4和2molNO2 , 则在该温度下的压强平衡常数Kp=(以分压表示的平衡常数为Kp , 分压=总压×物质的量分数)kPa。
-
(6) 电解氧化吸收法。电解0.1mol·L-1的NaCl溶液时,溶液中相关成分的质量浓度与电流强度的变化关系如图3。当电流强度为4A时,吸收NO的主要反应的离子方程式为(NO最终转化为NO
 )
)
 , 则甲烷燃烧的热化学方程式可表示为:
, 则甲烷燃烧的热化学方程式可表示为: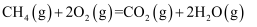
 B . 在101kPa时,2g
B . 在101kPa时,2g 完全燃烧生成液态水,放出285.8kJ热量,
完全燃烧生成液态水,放出285.8kJ热量, 燃烧的热化学方程式表示为
燃烧的热化学方程式表示为
 C . HCl和NaOH反应的中和热
C . HCl和NaOH反应的中和热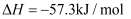 , 则
, 则 和
和 反应的中和热
反应的中和热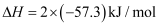 D . 500℃、30MPa下,已知热化学方程式:
D . 500℃、30MPa下,已知热化学方程式: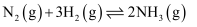
 , 将
, 将 和
和 置于密闭容器中充分反应生成
置于密闭容器中充分反应生成 , 放热38.6kJ
, 放热38.6kJ



