13.2 混合物的检验 知识点题库

|
阳离子 |
Fe3+、Al3+、Fe2+、Ba2+、Na+ |
|
阴离子 |
Cl-、CO32-、NO3-、SO42-、S2- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
-
(1) 该废水中一定含有的阴离子是 ,一定不含有的阳离子是;
-
(2) 写出Ⅰ中产生无色气体的反应的离子方程式:;
-
(3) 写出Ⅲ中通入过量CO2产生白色絮状沉淀所发生的反应离子方程式:;
-
(4) 在废水中加入新制氯水,测得溶液中c(Fe3+)=1.0×10-2mol·L-1 , c(Al3+)=1.0×10-3mol·L-1。要想使Fe3+完全沉淀(离子浓度为1.0×10-5mol·L-1)而Al 3+不沉淀,则应调节溶液pH范围为。(已知常温下Fe(OH)3的Ksp=1.0×10-38 , Al(OH)3的Ksp=1.0×10-33)
①澄清石灰水 ②品红溶液 ③酸性KMnO4溶液 ④溴水
 、Fe3+
B . 使紫色石蕊溶液变红的溶液:Fe2+、Mg2+、MnO
、Fe3+
B . 使紫色石蕊溶液变红的溶液:Fe2+、Mg2+、MnO  、Cl-
C . 常温下pH<7的溶液:K+、Ba2+、Cl-、Br-
D . 碳酸氢钠溶液:K+、SO
、Cl-
C . 常温下pH<7的溶液:K+、Ba2+、Cl-、Br-
D . 碳酸氢钠溶液:K+、SO  、Cl-、H+
、Cl-、H+
 离子中的两种组成(可重复选用),可以发生如图转化,下列说法正确的是( )
离子中的两种组成(可重复选用),可以发生如图转化,下列说法正确的是( ) 
 、SO
、SO  C . 在甲中滴加丁开始反应的离子方程式:HCO
C . 在甲中滴加丁开始反应的离子方程式:HCO  +Ba2++OH-=BaCO3↓+H2O
D . 白色沉淀A可能溶解在溶液D中
+Ba2++OH-=BaCO3↓+H2O
D . 白色沉淀A可能溶解在溶液D中
 、Ca2+、Cl-、
、Ca2+、Cl-、  、
、  中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法错误的是( )
中的若干种。为了确定该溶液的组成,取100mL上述溶液进行了如下实验(所加试剂均过量,气体全部逸出),下列说法错误的是( ) 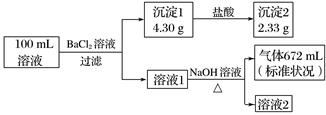
 、
、  和
和  B . 原溶液中一定不存在Ca2+ , 无法判断Cl-是否存在
C . 要确定Cl-是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D . 原溶液中c(K+)≥0.1mol·L-1
B . 原溶液中一定不存在Ca2+ , 无法判断Cl-是否存在
C . 要确定Cl-是否存在,可取少许溶液2加入硝酸银和稀硝酸检验
D . 原溶液中c(K+)≥0.1mol·L-1
 、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中, 正确的是( )
、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中, 正确的是( ) ①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
-
(1) I.硝酸钾KNO3用途广泛,用作分析试剂和氧化剂,制造炸药、在食品工业用作发色剂,护色剂,抗做生物剂,防腐剂,如用于腌肉,在午餐肉中起防腐作用。某KNO3溶液I含有少量的Fe3+、
 ,现从该溶液中获取纯净的KNO3晶体,进行如下操作。
,现从该溶液中获取纯净的KNO3晶体,进行如下操作。 
试剂1是
-
(2) 溶液III中主要存在的金属阳离子有
-
(3) 步骤4中发生的离子反应方程式为、
-
(4) 步骤5涉及的操作为、冷却结晶、过滤。
-
(5) II. 一份无色透明溶液中可能含有K+、Na+、Fe3+、H+、
 、
、  、
、  离子中的若干种,且离子个数相等。为了确定定溶液的组成,进行了如下操作:
离子中的若干种,且离子个数相等。为了确定定溶液的组成,进行了如下操作: ①取2mL溶液,加足量稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊。
②取2mL溶液,先加足量稀硝酸酸化,有气体产生,再加硝酸银溶液进行检验,有白色沉淀产生。
原溶液中一定不存在的阴离子是。
-
(6) 原溶液中一定存在的阳离子是。
 该离子的原子结构示意图为。
该离子的原子结构示意图为。
-
(7) 向该透明溶液中加入NaOH溶液,是否有反应发生?若没有,填“否”:若有,请写出有关的离子方程式。。
 、
、  、
、  、
、  、
、  、
、  、
、 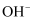 、
、  中的几种,回答下列回答(用离子符号填空):
中的几种,回答下列回答(用离子符号填空):
-
(1) 不做任何实验就可以确定原溶液中不存在的离子是。
-
(2) 取少量溶液,加入过量盐酸,有白色沉淀生成;再加入过量稀硝酸,沉淀不消失。根据此现象你得出的结论是。
-
(3) 取(2)中的滤液,加入过量稀氨水,出现白色沉淀,说明原溶液中肯定存在的离子是。生成白色沉淀的离子方程式是。
-
(4) 原溶液中一定含有的离子有;可能存在的离子有。
目的 | 方案设计 | 现象和结论 | |
A | 验证 | 取样与适量溴水混合,充分反应,观察现象 | 溴水褪色,说明样品分子中含有碳碳双键 |
B | 检验淀粉水解是否完全 | 将适量样品与稀硫酸反应,加入足量 | 无明显现象,说明淀粉水解完全 |
C | 检验牙膏中的摩擦剂成分 | 取少量牙膏于试管中,加水溶解,滤渣中滴加足量盐酸 | 若滤渣溶解并产生无色气泡,则摩擦剂可能为 |
D | 检验某固体是否为铵盐 | 取样品于试管中,滴加少量 | 若试纸不变蓝色,则固体不是铵盐 |
 }的实验如下:
}的实验如下:步骤1:向盛有硫酸铜水溶液的试管中加入氨水,首先生成难溶物,继续添加氨水并振荡试管,难溶物溶解,得到深蓝色的透明溶液。
步骤2:再向试管中加入乙醇,析出深蓝色的晶体。
下列说法错误的是( )
 中含有
中含有 键的数目为
键的数目为 D . 最终所得溶液中大量存在
D . 最终所得溶液中大量存在 、
、 、
、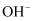 、
、
离子 | 方法 | |
A | I- | 滴加淀粉溶液 |
B | SO | 依次加入氯化钡溶液、稀盐酸 |
C | Fe2+ | 滴加K3[Fe(CN)6] |
D | Al3+ | 逐滴加入氨水至过量 |
 分子中的碳碳双键
分子中的碳碳双键 溶液后加入碘水,观察现象
溶液后加入碘水,观察现象