第二节 离子反应 知识点题库
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A . Cu(OH)2与盐酸,Cu(OH)2与醋酸
B . BaCl2溶液与Na2SO4溶液,Ba(OH)2溶液与H2SO4溶液
C . NaHCO3溶液与盐酸,Na2CO3溶液与盐酸
D . 石灰石与硝酸反应,石灰石与盐酸
下列离子方程式不正确的是( )
A . NaHCO3与NaOH溶液反应:HCO3﹣+OH﹣═CO32﹣+H2O
B . 氯气和水反应:Cl2+H2O⇌2H++Clˉ+ClOˉ
C . 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+
D . 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH﹣═SiO32﹣+H2O
下列离子反应方程式正确的是( )
A . 氯气溶于水:Cl2+H2O═2H++Cl﹣+ClO﹣
B . Fe2+与NO3﹣在酸性溶液中的反应:Fe2++NO3﹣+4H+=Fe3++NO↑+2H2O
C . 稀硫酸和Ba(OH)2溶液反应:H++SO42﹣+Ba2++OH﹣=BaSO4↓+H2O
D . 浓硝酸中加入铜片:Cu+4H++2NO3﹣═Cu2++2NO2↑+2H2O
下列叙述正确的是( )
A . 强电解质溶液的导电能力一定比弱电解质溶液强
B . 用相同的盐酸中和体积,物质的量浓度均相同的氢氧化钠和氨水溶液,所需盐酸的量相等
C . 将氢氧化钠和氨水溶液各稀释一倍,两者的OH﹣浓度均减少到原来的50%
D . 氢氧化钠溶液的物质的量浓度是氨水的两倍,则氢氧化钠的OH﹣浓度也是氨水溶液的两倍
下列各式中不正确的是( )
A . HF+H2O⇌H3O++F﹣
B . NaHCO3=Na++HCO3﹣ , HCO3﹣⇌H++CO32﹣
C . Ag2S(s)⇌2Ag+(aq)+S2﹣(aq)
D . S2﹣+2H2O⇌H2S+2OH﹣
下列物质的溶液能导电,但不属于电解质的是( )
A . Ba(OH)2
B . 蔗糖
C . Cl2
D . HCl
下表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 向沸腾的蒸馏水中滴加饱和的氯化铁溶液至液体变为红褐色:Fe3++3H2O=Fe(OH)3↓+3H+ | 正确 |
B | 大理石溶于醋酸的反应: CaCO3+2H+=Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | 错误,产物不符合客观事实 |
D | NaOH溶液中通入少量CO2反应: OH-+CO2=HCO3- | 正确 |
A . A
B . B
C . C
D . D
能正确表示下列反应的离子方程式的是( )
A . Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B . 0.1 mol·L-1 NH4Al(SO4)2溶液与0.2 mol·L-1 Ba(OH)2溶液等体积混合:Al3++2SO  +2Ba2++4OH-=2BaSO4↓+AlO
+2Ba2++4OH-=2BaSO4↓+AlO  +2H2O
C . 向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
D . 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO
+2H2O
C . 向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
D . 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO 
下列关于溶液中常见离子的检验及结论正确的是( )
A . 加入AgNO3溶液有白色沉淀产生,一定有Cl―
B . 加入BaCl2溶液有白色沉淀产生,再加盐酸,白色沉淀不消失,一定有SO4 2-
C . 加入Na2CO3溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+
D . 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4 +
下表为元素周期表的短周期部分。请填空。

-
(1) 写出 A 原子的最外层电子的轨道表示式,G、J、L 三种元素形成的简单离子中, 离子半径最小的是,D 元素的气态氢化物的电子式为;
-
(2) A 元素可形成化合物 Fe(AO)5 , 该物质常温下呈液态,熔点为-20.5℃,沸点为 103℃,易溶于 非极性溶液,据此可判断 Fe(AO)5 晶体属于(填晶体类型);
-
(3) 将 G 元素的最高价氧化物对应的水化物溶解在稀硫酸中,写出反应的离子方程式;当足量的铁和 2mol 单质 L 发生反应时,电子转移了mol;
-
(4) J 与 L 分别与氢元素形成的气态氢化物的稳定性关系为:>(填化学式)。
下列关于电解质溶液的叙述正确的是( )
A . 在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-)
B . 稀释醋酸溶液,溶液中所有离子的浓度均降低
C . 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+)
D . 0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S)
请根据题目要求回答以下问题:
-
(1) CuSO4·5H2O的摩尔质量是; 0.1mol CH4含有的氢原子数为; 0.2 mol·L-1的 AlCl3溶液中Cl-的物质的量浓度是。
-
(2) 现有以下物质:①NaCl ②氯水③醋酸 ④HCl ⑤酒精(C2H5OH)⑥CaCO3⑦Ba(OH)2属于强电解质的是,属于弱电解质的是。(填序号),写出Ba(OH)2的电离方程式.
下列关于电解质溶液的说法正确的是( )
A . 0.1mol/L的KA溶液 pH=6.5,则 HA一定为弱酸
B . 等 pH的盐酸和醋酸溶液加水稀释10倍后,c(Cl-)<c(CH3COO-)
C . 将 pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D . 常温下,pH相同的盐酸和醋酸,将两溶液升温至 80℃后溶液的 pH仍然相同
酸性KMnO4溶液、H2O2溶液在生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除。Fe(NO3)3溶液也是重要的氧化试剂,下面是对这三种氧化试剂性质的探究。
-
(1) 某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式:,氧化产物与还原产物的物质的量之比为。
-
(2) 取300mL0.2mol×L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3 , 则转移电子的物质的量是
-
(3) 测定KMnO4样品的纯度可用标准Na2S2O3溶液进行滴定,取0.474克KMnO4样品溶解酸化后,用0.100mol×L-1的标准Na2S2O3溶液进行滴定,标准Na2S2O3溶液应盛装在(填“酸式”或“碱式”)滴定管中。实验中,滴定至终点时消耗标准Na2S2O3溶液12.00mL,则该样品中KMnO4的物质的量是(有关离子方程式为8
 +5
+5 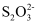 +14H+=8Mn2++10
+14H+=8Mn2++10  +7H2O)
+7H2O)
-
(4) 在溶Fe(NO3)3液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的原因是,又变为棕黄色的离子方程式是。
下列化学用语表示正确的是( )
A . 四氯化碳分子的比例模型:  B . 次氯酸的结构式:
B . 次氯酸的结构式:  C . 羟基的电子式:
C . 羟基的电子式:  D . 乙酸的电离方程式:
D . 乙酸的电离方程式: 
 C . 羟基的电子式:
C . 羟基的电子式: 
下列离子方程式书写正确的是( )
A . 碳酸钙和盐酸反应:  B . 向稀硝酸中加入少量亚硫酸钠:
B . 向稀硝酸中加入少量亚硫酸钠:  C . 向
C . 向  溶液中滴加稀盐酸:
溶液中滴加稀盐酸:  D . 向氯化亚铁溶液中通入氯气:
D . 向氯化亚铁溶液中通入氯气: 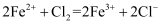
 B . 向稀硝酸中加入少量亚硫酸钠:
B . 向稀硝酸中加入少量亚硫酸钠:  C . 向
C . 向  溶液中滴加稀盐酸:
溶液中滴加稀盐酸:  D . 向氯化亚铁溶液中通入氯气:
D . 向氯化亚铁溶液中通入氯气: 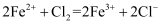
下列有关溶液导电能力的说法错误的是(忽略溶液混合时的体积变化)( )
A . 向氢氧化钡溶液中逐滴加入硫酸铜溶液至过量,溶液的导电能力先减弱后增强
B . 醋酸溶液中加入适量烧碱溶液,溶液的导电能力减弱
C . 盐酸的导电能力不一定比醋酸溶液强
D . 向氯化钠溶液中加入少量硝酸银溶液,溶液的导电能力几乎不变
下列各组中的离子,能在溶液中大量共存的是( )。
A . H+、Cl-、Ca2+、 B . Na+、Mg2+、
B . Na+、Mg2+、 、OH-
C . K+、Na+、OH-、Cl-
D . Cu2+、Ba2+、Cl-、
、OH-
C . K+、Na+、OH-、Cl-
D . Cu2+、Ba2+、Cl-、
 B . Na+、Mg2+、
B . Na+、Mg2+、 、OH-
C . K+、Na+、OH-、Cl-
D . Cu2+、Ba2+、Cl-、
、OH-
C . K+、Na+、OH-、Cl-
D . Cu2+、Ba2+、Cl-、
下列物质属于电解质的是( )
A . 盐酸
B . NaCl
C . CO2
D . Cl2
离子反应在物质分离、提纯、鉴定等方面有广泛的应用。实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为: ;操作②和③中,试剂1是
;操作②和③中,试剂1是 溶液,试剂2是
溶液,试剂2是 溶液,且二者均过量。
溶液,且二者均过量。
-
(1) 写出
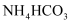 在水溶液中的电离方程式:;
在水溶液中的电离方程式:;
-
(2) 加入试剂1发生时反应的离子方程式:;
-
(3) 试剂2的目的是;
-
(4) 如何检验NaCl溶液产品中的
 ?
?
最近更新



