第二节 离子反应 知识点题库
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、NO3﹣、NH4+
④在由水电离出的c(OH﹣)=10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、I﹣
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl﹣、S2﹣、ClO﹣
⑥酸性溶液中:Fe2+、Al3+、NO3﹣、Cl﹣ .
A . ①②⑤
B . ②④
C . ②④⑥
D . ③⑤⑥
由已知电离常数判断,下列关于SO2与Na2CO3(aq)反应的离子方程式的书写中,不合理的是( )
酸 | 电离常数 |
碳酸 | K1=4×10﹣7 K2=5.6×10﹣11 |
亚硫酸 | K1=1.54×10﹣2K2=1.02×10﹣7 |
A . SO2+H2O+2CO32﹣═2 HCO3﹣+SO32﹣
B . SO2+H2O+CO32﹣═H2CO3+SO32﹣
C . 2SO2+2H2O+CO32﹣═H2CO3+2 HSO3﹣
D . SO2+H2O+CO32﹣═HCO3﹣+HSO3﹣
把17.1g Ba(OH)2固体分别加入到100mL 1mol/L的下列物质的溶液中,溶液导电能力变化最小的是( )
A . 醋酸
B . 碳酸钠溶液
C . CuSO4溶液
D . KCl溶液
在无色透明强酸性溶液中,能大量共存的离子组是( )
A . K+、Cu2+、NO3﹣、SO42﹣
B . K+、Na+、Cl﹣、ClO﹣
C . Zn2+、NH4+、NO3﹣、Cl﹣
D . K+、Na+、Ca2+、SO42﹣
在含有稀硫酸的硫酸铁溶液中,下列离子能大量共存的是( )
A . HCO3﹣
B . NO3﹣
C . SCN﹣
D . Ba2+
下列各离子组在指定的溶液中一定能大量共存的是( )
①常温在C(H+)/C(OH﹣)=10﹣10溶液中:K+、Na+、CH3COO﹣、SO42﹣
②常温pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
③水电离出的H+浓度c(H+)=10﹣12mol•L‾1的溶液中:Cl﹣、NO3﹣、Na+、S2O32﹣
④使甲基橙变红色的溶液中:Fe3+、NO3﹣、Na+、SO42﹣ .
A . ①②③
B . ①②④
C . ②③④
D . ①③④
下列离子方程式书写正确的是( )
A . 向FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl﹣
B . Ba(OH)2溶液与硫酸反应:OH﹣+H+═H2O
C . 次氯酸钙溶液中通入少量SO2:2ClO﹣+Ca2++SO2+H2O═CaSO3↓+2HClO
D . 碳酸氢钠溶液中加入过量石灰水:HCO3﹣+Ca2++OH﹣═CaCO3↓+H2O
下列各组离子在无色酸性溶液中可以大量共存的有( )
A . Ag+、K+、NO3﹣、Cl ﹣
B . K+、Cu2+、SO42﹣、HCO3﹣
C . Mg2+、Cl﹣、SO42﹣、Na+
D . CO32﹣、K+、NO3﹣、Na+
下列离子方程式中,属于水解反应的是( )
A . HCOOH+H2O⇌HCOO﹣+H3O+
B . CO32﹣+H2O⇌HCO3﹣+OH﹣
C . CO2+H2O⇌HCO3﹣+H+
D . HS﹣+H2O⇌S2﹣+H3O+
下列叙述正确的是( )
A . 取10.00 mL硫酸:在25mL酸式滴定管中装入硫酸,调整初始读数为15.00mL后,将剩余硫酸放入锥形瓶
B . 用乙酸浸泡水壶中的水垢,可将其清除,可以得出结论乙酸的酸性大于碳酸的酸性
C . SO2的水溶液能够导电,所以SO2是电解质
D . 测定醋酸溶液pH用玻璃棒蘸取溶液,点在湿润的pH试纸上
在强酸性、无色透明的溶液中,能够大量存在的离子组是 ( )
A . Na+、Mg2+、NO3-、Cl-
B . Na+、K+、CO32-、NO3-
C . K+、Ba2+、SO42-、Cl-
D . Na+、K+、MnO4-、SO42-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A . c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
B . 水电离出的c(H+)=10-l2mol/L 的溶液中:Ca2+、K+、Cl-、HCO3-
C . 能使甲基橙呈红色的溶液中:Fe2+、NO3-、SO42-、Na+
D . c(Fe3+)=0.1mol/L 的溶液中:K+、ClO-、SO42-、SCN-
写出下列化学反应的离子方程式
①NaOH溶液和HCl溶液
②Na2CO3和足量HCl
③H2SO4溶液和Ba(OH)2溶液
下列各组离子能够大量共存的是( )
A . 加入Al粉后产生  的溶液中:
的溶液中:  、
、  、
、  、
、  B . 滴加石蕊试剂变红的溶液中:
B . 滴加石蕊试剂变红的溶液中:  、 Fe2+ 、
、 Fe2+ 、  、
、  C . 酸性溶液中: Fe3+ 、
C . 酸性溶液中: Fe3+ 、  、
、 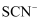 、
、  D . 澄清溶液中:
D . 澄清溶液中:  、
、 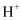 、
、  、
、 
 的溶液中:
的溶液中:  、
、  、
、  、
、  B . 滴加石蕊试剂变红的溶液中:
B . 滴加石蕊试剂变红的溶液中:  、 Fe2+ 、
、 Fe2+ 、  、
、  C . 酸性溶液中: Fe3+ 、
C . 酸性溶液中: Fe3+ 、  、
、 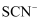 、
、  D . 澄清溶液中:
D . 澄清溶液中:  、
、 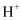 、
、  、
、 
关于电解质强弱及非电解质的组合完全正确的是( )
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | HClO | CH3COOH |
| 非电解质 | Cl2 | CO2 | C2H5OH | H2O |
A . A
B . B
C . C
D . D
某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
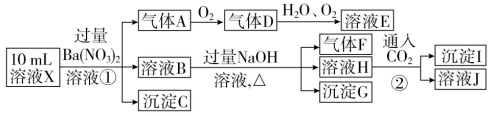
下列说法正确的是( )
A . X中一定存在Fe2+、Al3+、NH4+、SO42-
B . 溶液E和气体F能发生化学反应
C . X中肯定不存在CO32-、SO32-、Al3+
D . 沉淀I只有Al(OH)3
按要求填空:
-
(1) 明矾可用于净水,原因是
 用离子方程式表示
用离子方程式表示  。
。
-
(2) 把
 溶液蒸干、灼烧,最后得到的主要固体产物是。
溶液蒸干、灼烧,最后得到的主要固体产物是。
-
(3)
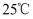 时,
时, 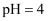 的盐酸中水的电离程度
的盐酸中水的电离程度  填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于” 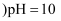 的
的 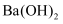 溶液中水的电离程度。
溶液中水的电离程度。
-
(4) 已知常温下,
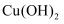 的溶度积常数为
的溶度积常数为 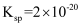 ,已知常温下某
,已知常温下某 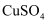 溶液里
溶液里  浓度为
浓度为 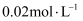 ,如果要生成
,如果要生成 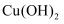 沉淀,则应调整溶液pH大于。
沉淀,则应调整溶液pH大于。
-
(5) 向含有AgI的饱和溶液中:
①加入固体
 ,则
,则 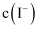
 填“变大”、“变小”或“不变”,下同
填“变大”、“变小”或“不变”,下同  。
。②若改加AgCl固体,则
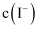 ,而
,而  。
。 -
(6) 常温下,将浓度为
 某一元酸HA和浓度为
某一元酸HA和浓度为  溶液等体积混合,混合后所得溶液的
溶液等体积混合,混合后所得溶液的 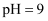 ,混合溶液中由水电离出的
,混合溶液中由水电离出的 
 。写出该混合溶液中下列算式的精确结果
。写出该混合溶液中下列算式的精确结果 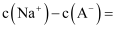
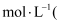 不能近似处理
不能近似处理 
NaHSO4溶于水时和熔融态下电离方式有所不同,向NaHSO4溶液中分别加入下列物质,有气体生成的是( )
A . NaHCO3
B . Ba(OH)2
C . BaCl2
D . CuO
下列反应的化学方程式或离子方程式书写正确的是( )
A . 氢氧化钡溶液与硫酸铜溶液反应:Ba2++  =BaSO4↓
B . CH4在光照条件下与Cl2反应:CH4+Cl2
=BaSO4↓
B . CH4在光照条件下与Cl2反应:CH4+Cl2 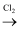 CH3Cl+HCl
C . 向氯化铝溶液中滴加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
D . 碳酸钙溶于盐酸:
CH3Cl+HCl
C . 向氯化铝溶液中滴加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
D . 碳酸钙溶于盐酸:  +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
 =BaSO4↓
B . CH4在光照条件下与Cl2反应:CH4+Cl2
=BaSO4↓
B . CH4在光照条件下与Cl2反应:CH4+Cl2 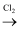 CH3Cl+HCl
C . 向氯化铝溶液中滴加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
D . 碳酸钙溶于盐酸:
CH3Cl+HCl
C . 向氯化铝溶液中滴加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
D . 碳酸钙溶于盐酸:  +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
工业上常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某课外兴趣小组拟从上述腐蚀废液中(含FeCl3、FeCl2、CuCl2)回收铜,并重新获得FeCl3溶液,设计流程如下:

回答下列问题:
-
(1) 写出FeCl3溶液与金属铜发生反应的离子方程式: 。
-
(2) 检验废液中Fe3+存在的试剂是,证明Fe3+存在的现象是。
-
(3) 经检验知废液中仍有Fe3+存在。
①废液中加入过量a,发生的化学反应方程式为;
②过滤操作中需要使用的玻璃仪器有烧杯、;滤渣c的成分为。
-
(4) 写出b与e反应的化学方程式:。
最近更新



