第二节 离子反应 知识点题库
下列离子反应方程式正确的是( )
A . Fe (OH )3 溶于稀 H 2 SO4 中:H++OH﹣→H2O
B . 氨水滴入 AlCl 3 溶液中:Al3++3OH﹣→Al(OH)3↓
C . FeO 溶于稀 HCl 中:O2﹣+2H+→H2O
D . 铝溶解在 NaOH 溶液中:2Al+2OH﹣+2H2O→2AlO2﹣+3H2↑
能正确表示下列化学反应的离子方程式的是( )
A . 氢氧化钡溶液与硫酸的反应OH﹣+H+═H2O
B . 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O
C . 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag
D . 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑
下列离子方程式书写正确的是( )
A . 盐酸中滴入碳酸钠溶液:CO32﹣+2H+=H2O+CO2↑
B . 铁粉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
C . 盐酸中滴入氢氧化钠溶液:HCl+OH﹣=H2O+Cl﹣
D . 稀硝酸滴在石灰石上:CO32﹣+2H+=H2O+CO2↑
处于下列状态的物质:A.氯化钠晶体 B.CO2 C.无水醋酸 D.铁E.BaSO4 F.熔融的氯化镁 G.酒精 H.氨水 (请用字母填写).
-
(1) 上述物质中能导电的是:
-
(2) 上述物质中属于电解质的是:
-
(3) 上述物质中属于非电解质的是:.
下列物质中能导电的是( )
A . 稀硫酸
B . 蔗糖
C . CuSO4•5H2O
D . NaCl固体
下列各组离子能在溶液中大量共存的是( )
A . Na+、Mg2+、Cl﹣、OH﹣
B . H+、Ca2+、CO32﹣、NO3﹣
C . Na+、HCO3﹣、OH﹣、Ca2+
D . Cu2+、K+、SO42﹣、NO3﹣
下列物质溶液间中的反应可用离子方程式OH-+ H+→H2O表达的是:( )
A . H2SO4和Ba(OH)2
B . NH3·H2O和HCl
C . NaHSO4和KOH
D . NaHCO3和NaOH
下列框图涉及到的物质所含元素中,除一种元素外,其余均为1~18号元素。

已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
-
(1) 常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为。
-
(2) E与G的稀溶液反应的离子方程式为。
-
(3) 在25℃和101kPa的条件下,将V L的B气体溶于100mL水中,得到密度为ρg/cm3的溶液M,则M溶液的物质的量浓度为mol/L。(已知25℃、101kPa条件下气体摩尔体积为24.5 L/mol,不必化简)
-
(4) 分别蘸取M的浓溶液和G的浓溶液的玻璃棒,接近后的现象是。
-
(5) B和C反应的化学方程式为。
-
(6) J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式。
下列物质在水溶液中的电离方程式中,正确的是( )
A . CH3COOH=CH3COO-+H+
B . NH3·H2O  NH4++OH-
C . BaCl2=Ba2++ Cl2-
D . NaHCO3=Na++H++CO3-
NH4++OH-
C . BaCl2=Ba2++ Cl2-
D . NaHCO3=Na++H++CO3-
小明同学为研究有机物A和B的结构和性质,分别取7.4gA和6.0gB置于密闭容器中完全燃烧,测得有关数据如下:

由以上信息可求出:
-
(1) A物质的分子式为。已知A和金属Na不反应,则其可能的结构有种。
-
(2) B物质的最简式为。所有符合该最简式的物质中,相对分子质量最小的物质与酸性高锰酸钾反应的离子方程式为 。
-
(3) 相同条件下,相同质量B物质的蒸气所占体积为H2体积的1/30,且B可以发生银镜反应,但不能发生水解反应。写出其结构简式 。
-
(4) 若B分子中有3个碳原子,能与NaHCO3反应产生CO2气体,且等效氢的个数比为3:1:1:1,则该物质的系统命名法名称为 。
-
(5) 若符合B物质最简式的某物质是生命体中重要的能量物质,在一定条件下可以转化为乙醇,写出该转化反应的化学方程式。
室温下,下列各组离子在指定溶液中能大量共存的是( )
A . 0.1mol·L−1NaOH溶液:Na+、K+、  、
、  B . 0.1mol·L−1FeCl2溶液:K+、Mg2+、
B . 0.1mol·L−1FeCl2溶液:K+、Mg2+、  、
、  C . 0.1mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D . 0.1mol·L−1H2SO4溶液:K+、
C . 0.1mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D . 0.1mol·L−1H2SO4溶液:K+、  、
、  、
、 
 、
、  B . 0.1mol·L−1FeCl2溶液:K+、Mg2+、
B . 0.1mol·L−1FeCl2溶液:K+、Mg2+、  、
、  C . 0.1mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D . 0.1mol·L−1H2SO4溶液:K+、
C . 0.1mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D . 0.1mol·L−1H2SO4溶液:K+、  、
、  、
、 
下列离子能大量共存的是( )
A . Fe 2+、NO3-、H+、SO42-
B . Mg2+、Al3+、NO3-、SO42-
C . Fe3+、NH4+、SCN-、Cl-
D . Ca2+、NO3-、Na+、CO32-
已知电导率越大导电能力越强。常温下用0.10 mol·L-1NaOH溶液分别滴定10mL浓度均为0.10 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A . 曲线①代表滴定盐酸的曲线
B . 滴定醋酸的过程应该选择甲基橙作为指示剂
C . a、b、c三点溶液中水的电离程度:c>a>b
D . b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
在溶液中加入过量Na2O2后仍能大量共存的是( )
A . NH4+、Ba2+、Cl-、NO3-
B . K+、CO32-、AlO2-、SO42-
C . Fe2+、Mg2+、SCN-、Cl-
D . Na+、HCO3-、SO32-、I-
下列离子方程式正确的是( )
A . 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
B . 大理石与稀硝酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C . 硫酸溶液与氧氧化钡溶液混合:H++SO42-+Ba2++OH-=H2O+BaSO4↓
D . MgCl2溶液与过量氨水反应:Mg2++2OH-=Mg(OH)2↓
下列各组离子在碱性条件下可以大量共存,在酸性条件下因发生氧化还原反应而不能大量共存的是( )
A . Cu2+ Fe2+ NO3- Cl–
B . K+ Mg2+ HSO3- SO42-
C . S2- Na+ K+ Cl-
D . Ba2+ Na+ I- NO3-
图a~c分别为NaCl在不同状态下的导电实验(X、Y为石墨电极)微观示意图。下列分析错误的是( )
| | | |
| 图a | 图b | 图c |
A . 图中  代表
代表  B . a:NaCl固体,不导电
C . b:X与电源负极相连
D . c:Y上产生
B . a:NaCl固体,不导电
C . b:X与电源负极相连
D . c:Y上产生 
 B . a:NaCl固体,不导电
C . b:X与电源负极相连
D . c:Y上产生
B . a:NaCl固体,不导电
C . b:X与电源负极相连
D . c:Y上产生 
下列离子方程式书写正确的是( )
A .  溶于醋酸:
溶于醋酸:  B . 向
B . 向 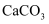 中滴入盐酸:
中滴入盐酸:  C . 向
C . 向  溶液中加入
溶液中加入 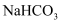 溶液:
溶液:  D . 向
D . 向  溶液中通入
溶液中通入 
 溶于醋酸:
溶于醋酸:  B . 向
B . 向 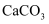 中滴入盐酸:
中滴入盐酸:  C . 向
C . 向  溶液中加入
溶液中加入 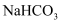 溶液:
溶液:  D . 向
D . 向  溶液中通入
溶液中通入 
 和
和 在工业上用途广泛,某同学为探究
在工业上用途广泛,某同学为探究 、
、 的性质,设计如下装置进行实验。
的性质,设计如下装置进行实验。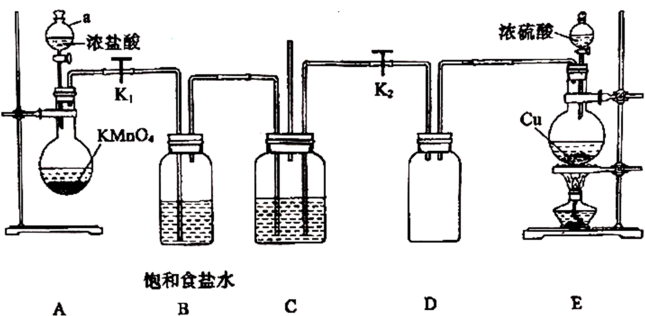
-
(1) 图中仪器a的名称,E中发生反应的化学方程式为。
-
(2) 若C中加入淀粉碘化钾溶液,关闭
 , 打开
, 打开 , 使A产生的气体进入C,则C中实验现象为。
, 使A产生的气体进入C,则C中实验现象为。
-
(3) 若C中加入品红溶液,打开
 、
、 , 使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为(用离子方程式表示)。
, 使A、E产生的气体同时进入C中,观察到C中品红溶液没有褪色,原因可能为(用离子方程式表示)。
-
(4) 若C中加入
 溶液,先打开
溶液,先打开 , 使E产生的气体进入C,观察到C中无明显现象,再打开
, 使E产生的气体进入C,观察到C中无明显现象,再打开 , 使A产生的气体进入C,观察到C中产生白色沉淀。则此白色沉淀为(填化学式)。
, 使A产生的气体进入C,观察到C中产生白色沉淀。则此白色沉淀为(填化学式)。
-
(5) 该同学设计的装置有一处明显的缺陷是。
回答下列问题:
-
(1) 以Fe、CuO、H2SO4三种物质为原料,用两种方法制取铜(用化学方程式表示):
方法一:。
方法二:。
-
(2) 请写出NH4NO3的电离方程式:。
-
(3) 请写出与O2互为同素异形体的物质的化学式:
-
(4) 当光束通过下列物质时,不会出现丁达尔现象的分散系有 (填字母)。
A.氢氧化铁胶体 B.水 C.蔗糖溶液 D.氯化铁溶液 E.云、雾
最近更新






