第二节 氯及其化合物 知识点题库
A | B | C | D | |
X | SO2 | Cl2 | NH3 | SO2 |
Y | H2S | CO2 | CO2 | Cl2 |
选项 | 操作 | 现象 | 结论 |
A | KI淀粉溶液中滴入氯水,再通入SO2 | 先变蓝色后褪色 | SO2有漂白性 |
B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
C | 向白色ZnS沉淀上滴加0.1mol/LCuSO4溶液 | 沉淀变为黑色 | Ksp(ZnS)>Ksp(CuS) |
D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
①新制氯水久置后→浅黄绿色消失
②Cl2通入石蕊试液中→先变红后褪色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
, 4HCl(浓)+MnO2  Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:

-
(1) 请指出是氧化剂,是还原剂,写出该反应的离子方程式.
-
(2) 集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是.
-
(3) 氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境.实验室中可采
用溶液来吸收有毒的氯气.

在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:

-
(1) 装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为:装置2中所加试剂为;
-
(2) 装置4中试剂为固体
 和
和  :发生反应的化学方程式为;试管口不能向上倾斜的原因是。装置3中试剂为
:发生反应的化学方程式为;试管口不能向上倾斜的原因是。装置3中试剂为 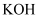 ,其作用为。
,其作用为。
-
(3) 反应时三颈瓶需用冷水浴冷却,其目的是。

已知:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
-
(1) C装置的作用是。
-
(2) 氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:;
化学性质变化:。
-
(3) 乙同学从B中取出一定量的样品后通入SO2 , 充分作用后再滴入少量品红溶液,发现品红溶液不褪色。原因是(用离子方程式表示)。丙同学改变通入SO2的量,重复乙同学的操作,发现品红溶液红色褪去。他提出:假设①:SO2过量,多余的SO2使品红溶液褪色;假设②:。请设计实验验证假设①是否成立:。
-
(4) 为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂a应选择;试剂b应选择。
-
(5) 戊同学从B中取出少量样品,滴到NaHCO3粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由。
 B . 鉴别纯碱与小苏打
B . 鉴别纯碱与小苏打  C . 证明Cl2能与烧碱溶液反应
C . 证明Cl2能与烧碱溶液反应  D . 探究钠与Cl2反应
D . 探究钠与Cl2反应 

-
(1) 装置A中存在一处不正确,改正这处不正确:。
-
(2) 配平装置A中发生反应的化学方程式:KClO3+HCl(浓) =KCl+Cl2↑+H2O。
-
(3) 为除去氯气中的氯化氢,需要在装置A、B之间添加装置E,其中加入。(填试剂名称),为了探究有色布条褪色的原理,需再添加装置E,其中加入浓硫酸,在整套装置中的添加位置为(填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
-
(4) 将氯气通入冷的石灰乳中,即可制得以(填化学式)为有效成分的漂白粉,发生反应的化学方程式为。
-
(5) 有同学认为,上述装置还有另外一处的缺陷,并给出了改进措施。该改进措施是。
 )是一种黄绿色气体,易溶于水,在水中的溶解度约为
)是一种黄绿色气体,易溶于水,在水中的溶解度约为 的5倍,其水溶液在较高温度与光照下会生成
的5倍,其水溶液在较高温度与光照下会生成 与
与 。
。 是一种极易爆炸的强氧化性气体,下列有关物质的性质和用途具有对应关系的是( )
是一种极易爆炸的强氧化性气体,下列有关物质的性质和用途具有对应关系的是( )
 能溶于水,可用于工业制盐酸
B .
能溶于水,可用于工业制盐酸
B .  有强氧化性,可用于水体杀菌消毒
C . HClO不稳定,可用于棉、麻漂白
D .
有强氧化性,可用于水体杀菌消毒
C . HClO不稳定,可用于棉、麻漂白
D .  溶液呈酸性,可用于蚀刻电路板上的铜
溶液呈酸性,可用于蚀刻电路板上的铜
目的 | 方案设计 | 现象和结论 | |
A | 验证NaCl、Na2SO4、NaOH混合溶液中的Cl- | 取混合溶液于试管中,加入过量的Ba(NO3)2溶液充分反应,静置,向上清液中滴加AgNO3溶液 | 若上清液变浑浊。则混合溶液中含有Cl- |
B | 证明氧化性:Cl2>Fe3+> | 向2支盛有FeCl2溶液的试管中分别加入氯水。向其中一支滴加KSCN溶液,向另一支依次滴加H2SO3溶液相BaCl2溶液 | 第一支试管中溶液变成血红色, 第二支试管中产生白色沉淀,则证明氧化性:Cl2>Fe3+> |
C | 证明CH4和Cl2光照下发生取代反应 | 将装有干燥Cl2的集气瓶倒扣在装有干燥CH4的集气瓶上,抽出玻璃片,置于光照条件下反应 | 观察到集气瓶内出现白雾,则证明CH4与Cl2发生了取代反应 |
D | 探究AgCl和AgI的溶解度的大小 | 向2支盛有2mL相同浓度硝酸银溶液的试管中分别加入相同滴数同浓度的NaCl和NaI溶液 | 若一支试管中无明显现象,另一支试管中产生黄色沉淀,则AgCl溶解度大于AgI |




