第二节 氯及其化合物 知识点题库
Cl2和SO2都具有漂白作用,能使品红溶液褪色.若将等物质的量的Cl2、SO2混合后,再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色②溶液不褪色③出现沉淀④不出现沉淀.
A . ①②
B . ①③
C . ②③
D . ②④
化学学习方法中的类推法是由已学知识通过迁移构建新知识的方法.下列类比正确的是( )
A . CaCO3与稀硝酸反应生成CO2 , CaSO3也能与稀硝酸反应生成SO2
B . 铜在Cl2中燃烧生成二价铜,铜也能在硫蒸气中燃烧生成二价铜
C . 锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应
D . 钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气
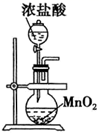
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

-
(1) 装置A是氯气的发生装置,其中盛放浓盐酸的仪器名称是,请写出该反应相应的离子方程式:.
-
(2) 装置B中饱和食盐水的作用是;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:.
-
(3) 装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是(填字母编号).
编号
Ⅰ
Ⅱ
Ⅲ
a
干燥的有色布条
碱石灰
湿润的有色布条
b
干燥的有色布条
无水硫酸铜
湿润的有色布条
c
湿润的有色布条
浓硫酸
干燥的有色布条
d
湿润的有色布条
无水氯化钙
干燥的有色布条
-
(4) 设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是,该现象(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是(用必要的文字和离子方程式回答).
-
(5) 此装置需要改进之处是:原因是:.
下列实验方案可行的是( )
A . 用浓硫酸干燥氨气
B . 用酚酞试液检验酸性溶液
C . 通入Cl2除去FeCl3溶液中的FeCl2
D . 加入Fe粉除去Al3+溶液中的杂质Cu2+
取三张蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加65%的HNO3、98%的H2SO4和新制的氯水,三张试纸呈现的颜色分别是( )
A . 白、红、白
B . 红、黑、白
C . 红、红、红
D . 白、黑、白
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
A . 铁与氯气反应制氯化铁,推出铁与碘反应制碘化铁
B . CO2通入到漂白粉溶液中发生CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推出SO2通入到漂白粉溶液中发生SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
C . Na2O2与CO2反应生成Na2CO3和O2 , 推出Na2O2与SO2反应可生成Na2SO3和O2
D . 利用可溶性的铝盐溶液与氨水反应制Al(OH)3 , 推出可溶性的铁盐溶液与氨水反应制Fe(OH)3
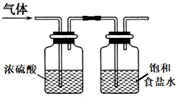
如图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题.

-
(1) A是氯气发生装置,其中发生反应的离子方程式为.
-
(2) 实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl.D中发生反应的化学方程式为,装置C的作用是.
-
(3) 实验过程中,E处产生的现象为.
-
(4) D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是,装置B的作用是.
-
(5) 若实验中使12mol•L﹣1的浓盐酸10mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03mol,其原因是.
-
(6) 若要吸收从硬质玻璃管中导出的气体,E中应盛放溶液,其中有毒气体与之反应的离子方程式是.
下列物质能使品红溶液褪色的是( )
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫.
A . ①③④
B . ②③④
C . ①②④
D . ①②③④
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”. S2O32﹣和Cl2反应的产物之一为SO42﹣ . 下列说法中,不正确的是( )
A . 上述反应中,每生成1mol SO42﹣ , 可脱去2mol Cl2
B . 该反应中氧化剂是Cl2 , 反应消耗的氧化剂与还原剂之比为4:1
C . 根据该反应可判断还原性:S2O32﹣>Cl﹣
D . SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强
下列对氯气的叙述中正确的是( )
A . 能与所有金属反应
B . 具有氧化性
C . 不能支持燃烧
D . 具有漂白作用
下列说法正确的是( )
A . 用澄清石灰水可以鉴别碳酸钠和碳酸氢钠
B . 新制氯水经光照一段时间pH减小
C . 自然界硅元素贮量丰富,并存在大量的单质硅
D . 等质量的碳酸钠与碳酸氢钠分别于足量盐酸反应,产生二氧化碳质量相同
某白色固体混合物,为了鉴定其成分进行如下实验:
①取少量样品加足量水充分混合,观察到气体产生,反应后仍有部分固体未溶解,过滤;
②滤渣加入足量NaOH溶液,滤渣溶解;
③滤液中加足量稀硝酸酸化,再加几滴AgNO3溶液,产生白色沉淀。该白色粉末可能是()
A . AlCl3和NH4HCO3
B . AlBr3和NaHCO3
C . Ba(OH)2和(NH4)2CO3
D . CaCl2和(NH4)2SO3
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是( )

A . 苛性钾溶液中KOH的物质的量是0.09 mol
B . ClO的生成是由于氯气的量的多少引起的
C . 在酸性条件下ClO-和ClO可生成Cl2
D . 反应中转移电子的物质的量是0.21 mol
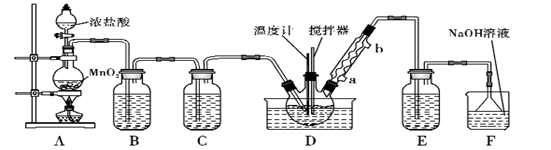
一氯化硫(S2Cl2)是一种重要的有机合成氯化剂,实验室和工业上都可以用纯净干燥的氯气与二硫化碳反应来制取(CS2+3Cl2 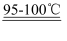 CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
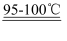 CCl4+S2Cl2),其装置如下:
CCl4+S2Cl2),其装置如下:
-
(1) A装置中的离子反应方程式为。
-
(2) 一氯化硫(S2Cl2)常温下较为稳定,受热易分解,易被氧化,且遇水即歧化,歧化产物中不仅有淡黄色固体,而且还有两种气体,用NaOH溶液吸收该气体可得两种盐Na2SO3和NaCl。 写出一氯化硫与水反应的化学反应方程式。
-
(3) B装置的作用是。
-
(4) D中冷凝管的冷水进水口为(填“a”或“b”);实验过程中,需要先点燃A处酒精灯,通入氯气一段时间后方可向D中水槽里面加入热水加热,这样做的目的是。
-
(5) F装置是用来处理尾气氯气的,已知该吸收反应的氧化产物不仅有NaClO还有NaClO3 , 且n(NaClO)/n(NaClO3)=3/1,则该反应被还原的氯原子与被氧化的氯原子物质的量之比为。
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A . 将NaHCO3固体加入新制氯水,有无色气泡(H+)
B . 使红色布条褪色(HCl)
C . 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D . 滴加AgNO3溶液生成白色沉淀(Cl-)
下列有关物质性质与用途具有对应关系的是( )
A . SO2具有氧化性,可用于漂白纸浆
B . Si的熔点高,可用作半导体材料
C . FeCl3溶液显酸性,可用于蚀刻铜制的电路板
D . 漂白液中含有强氧化性物质,可作漂白剂和消毒剂
已知实验室制取氯气的反应原理为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
-
(1) 该反应中氧化剂是(填化学式),氧化产物是。
-
(2) 该反应中氧化剂与还原剂的个数比为。
-
(3) 用单线桥法表示电子转移的方向和数目:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
-
(4) “地康法”制取氯气的总反应方程式4HCl+O2==2H2O+2Cl2 , 其反应原理如图所示:
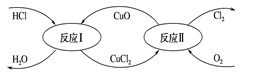
反应Ⅰ:CuO+2HCl=CuCl2+H2O
反应Ⅱ:……
①反应Ⅰ的离子方程式为。
②反应Ⅱ的化学方程式为。
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 将4.6g 钠用铝箔包裹并刺小孔,与足量水充分反应生成H2分子数为0.1 NA
B . 标准状况下,22.4L 己烷中含有的共价键的数目为19NA
C . 标准状况下,11.2L 12C18O中含有的中子数为8NA
D . 标准状况下,7.1 gCl2通入足量石灰水中反应转移的电子数为0.2NA
常温下氯化铜为浅绿色固体,易潮解,实验室设计如下实验制备无水氯化铜。

A B C D
回答下列问题:
-
(1) 盛放浓盐酸的仪器名称为。
-
(2) 实验操作的先后顺序为(填选项字母)。
a.点燃A处酒精灯 b.点燃C处酒精灯 c.按图连接装置 d.向装置中添加相应药品 e.检查装置气密性
-
(3) 装置A中发生反应的离子方程式为。
-
(4) 填写表中装置加入试剂的目的。
装置序号
加入的试剂
加入该试剂的目的
B
浓
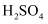
D
 溶液
溶液 -
(5) 某同学提出该装置存在缺陷,应增加一个干燥装置,该装置应该加在______(填序号)。A . A与B之间 B . B与C之间 C . C与D之间 D . D之后
-
(6) 用改进后的装置进行实验,若C中开始时加入Cu粉6.40g,反应结束后,得到12.79g固体(设除
 外,Cu未与其他物质发生反应),则固体中
外,Cu未与其他物质发生反应),则固体中 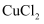 的物质的量为。
的物质的量为。
1774年,舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名―氯气)。实验室制取Cl2时,下列装置能达到相应实验目的的是( )
| A | B | C | D |
| | | | |
| 制备Cl2 | 净化Cl2 | 收集Cl2 | 尾气处理 |
A . A
B . B
C . C
D . D
最近更新