第二节 氯及其化合物 知识点题库
下列叙述正确的是( )
A . 金属单质与盐溶液的反应都是置换反应
B . 加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾难溶于水
C . 与强酸、强碱都反应的物质只有两性氧化物和两性氢氧化物
D . 氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
传统饮用水的消毒剂是氯气。20世纪80年代初期科研人员在英国某城市调查发现,儿童白血症发病率高是源于饮用了用氯气消毒的饮用水,这是因为( )
A . 氯气有氧化性,会作用于正常细胞而癌变
B . 氯水中的次氯酸具有杀菌性,正常细胞被氧化后转化为癌细胞
C . 氯气有毒,杀死正常细胞,不杀灭癌细胞
D . 氯气与水中有机物作用,生成有机氯化物而致癌
下列推断正确的是( )
A . SiO2是酸性氧化物,能与NaOH溶液反应
B . Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C . CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D . 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
实验室制备氯气的反应原理为MnO+4HCl( 浓)  MnCl2+Cl2↑+2H2O,然后用制取的气体进行性质实验。请完成下列问题:
MnCl2+Cl2↑+2H2O,然后用制取的气体进行性质实验。请完成下列问题:
 MnCl2+Cl2↑+2H2O,然后用制取的气体进行性质实验。请完成下列问题:
MnCl2+Cl2↑+2H2O,然后用制取的气体进行性质实验。请完成下列问题: 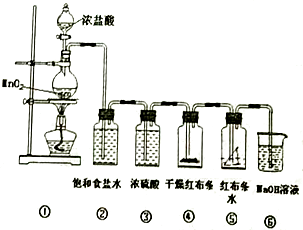
-
(1) 制取氯气的反应中还原剂与氧化剂的物质的量之比为;
-
(2) 氯气不溶于饱和食盐水,装置②的作用:;浓硫酸的作用: ;
-
(3) ④布条上现象: ;⑤布条上现象: ;
-
(4) NaOH 溶液中发生反应的主要离子方程式为。
将等物质的量的SO2、Cl2通入水中,所得的溶液( )
A . 具有中性、漂白性
B . 有酸性
C . 无漂白性
D . 具有酸性、漂白性
-
(1) 写出Mg在CO2中燃烧的化学方程式。
-
(2) 最近报纸上报导了有人混用洗涤剂发生了中毒事件,当事人先用洁厕灵(强酸性,含盐酸)洗卫生间,再用84消毒液(含NaClO)进行杀菌。
请写出涉及反应的离子方程式。
-
(3) 碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,其中H-具有较强的还原性。
常用NaH在高温下将TiCl4还原成Ti,反应的化学方程式为。
NaH能与水剧烈反应生成对应的碱和氢气,该反应中氧化产物和还原产物的质量比为。
下列说法正确的是 ( )
A . 二氧化硫和漂白粉都具有漂白作用,它们都能使溴水和高锰酸钾溶液褪色
B . 过氧化钠和二氧化硫都具有漂白作用,它们都能使品红溶液褪色
C . 二氧化硫和氯气都具有漂白作用,它们都能使石蕊试液先变红色再褪色
D . 盐酸能使滴有酚酞的氢氧化钠溶液褪色,所以盐酸也有漂白性
下列关于氯气的说法错误的是( )
A . 尽管氯气的化学性质很活泼,但是干燥的液氯能用钢瓶贮存
B . 氯气和液氯是两种不同的物质
C . 可以用浓硫酸除去氯气中的水蒸气
D . 氯气有毒,它曾在战争中被用于制造毒气弹
物质的性质决定其用途。下列说法错误的是( )
A . 利用钠在电光源上发出的黄色光透雾能力强的特点制高压钠灯
B . 利用氯气的强氧化性漂白干燥的有色布条
C . 液氨汽化时要吸收大量的热,使周围的温度急剧下降,可用作制冷剂
D . 常温下,铝遇浓硝酸发生钝化,可用铝制容器盛装和运输浓硝酸
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
-
(1) 工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为。
-
(2) 漂白粉的有效成分是 (填化学式)。
-
(3) 瓶装漂白粉久置于空气中呈稀粥状而失效。试用化学方程式表示漂白粉在空气中易失效的因:。
-
(4) 结合氯气的相关知识解决下列问题, 已知漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同。
①漂白粉与稀盐酸发生复分解反应,化学方程式为。
②漂白粉与浓盐酸发生氧化还原反应,化学方程式为。
新冠肺炎对生产生活带来了巨大冲击。医用酒精、含  的消毒液可用于个人与环境消毒,但含
的消毒液可用于个人与环境消毒,但含  的消毒液与医用酒精不可混用,混用会产生有毒气体
的消毒液与医用酒精不可混用,混用会产生有毒气体  ,发生的主要反应为:①
,发生的主要反应为:①  ,②……(后续反应略)。
,②……(后续反应略)。
 的消毒液可用于个人与环境消毒,但含
的消毒液可用于个人与环境消毒,但含  的消毒液与医用酒精不可混用,混用会产生有毒气体
的消毒液与医用酒精不可混用,混用会产生有毒气体  ,发生的主要反应为:①
,发生的主要反应为:①  ,②……(后续反应略)。
,②……(后续反应略)。 下列关于氯气和新制氯水的说法正确的是( )
A . 足量铁丝在  中燃烧生成
中燃烧生成  B . 向加有淀粉的
B . 向加有淀粉的 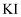 溶液中通入少量
溶液中通入少量  后溶液变蓝,说明
后溶液变蓝,说明  的氧化性强于
的氧化性强于  C .
C .  溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有
溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有  D . 用强光照射新制氯水一段时间后,溶液
D . 用强光照射新制氯水一段时间后,溶液  增大
增大
 中燃烧生成
中燃烧生成  B . 向加有淀粉的
B . 向加有淀粉的 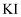 溶液中通入少量
溶液中通入少量  后溶液变蓝,说明
后溶液变蓝,说明  的氧化性强于
的氧化性强于  C .
C .  溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有
溶液中滴加新制氯水,溶液变成棕黄色,说明新制氯水中含有  D . 用强光照射新制氯水一段时间后,溶液
D . 用强光照射新制氯水一段时间后,溶液  增大
增大
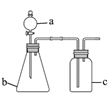
用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是( )
| 选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
| A | 氨水 | CaO | 无 | 制取并收集氨气 | |
| B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
| C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
| D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A . A
B . B
C . C
D . D
下列有关物质性质和用途说法错误的是( )
A . 液氨可用作制冷剂
B . MgO熔点很高,可用于制造耐火材料
C . SO2可用作食品防腐剂
D . ClO2可用于杀菌消毒,H2O2不可以
向氯水中加入下列物质,表中各项正确的是( )
| 选项 | 加入物质 | 现象 | 解释或离子方程式 |
| A | AgNO3溶液 | 有白色沉淀生成 | Cl-+Ag+=AgCl↓ |
| B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
| C | CaCO3 | 有气体放出 | CO |
| D | 有色布条 | 有色布条褪色 | Cl2有漂白性 |
A . A
B . B
C . C
D . D
下列说法中错误的有( )
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②测定新制氯水的  时,先用玻璃棒蘸取液体滴在
时,先用玻璃棒蘸取液体滴在  试纸上,再与标准比色卡对照;
试纸上,再与标准比色卡对照;
③用米汤直接检验食用盐中是否含有碘元素;
④  在5.6~7.0之间的降水通常称为酸雨;
在5.6~7.0之间的降水通常称为酸雨;
⑤加入 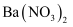 溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有
溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有  存在;
存在;
⑥  通入紫色石蕊试液,溶液先变红后褪色;
通入紫色石蕊试液,溶液先变红后褪色;
⑦配制一定物质的量浓度的氢氧化钠溶液,用烧杯称量后加蒸馏水溶解,未冷却到室温便转移到容量瓶中,导致结果偏高;
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤;
⑨蒸干  溶液可得纯净的无水氯化铝;
溶液可得纯净的无水氯化铝;
A . 5个
B . 6个
C . 7个
D . 8个
氯及其许多化合物既是重要的化工原料,又是高效、广普的灭菌消毒剂。请回答下列问题:
-
(1) 写出用二氧化锰和浓盐酸制备氯气的化学方程式;实验室将过量的二氧化锰和100mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.3mol,其原因有。
-
(2) 将氯气通入冷的石灰乳中可以制得较稳定的漂白粉漂白粉的有效成分是 (写化学式)。
-
(3) 84消毒液(有效成分为NaClO)与洁厕灵(有效成分为盐酸)混用易发生中毒的原因是 (用离子方程式表示)。
-
(4) ClO2常温下为黄色气体,易溶于水,其水溶液是一种广普杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,溢出大量CO2 , 得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应(氧化剂和还原剂为同种物质中的同种元素的反应),每消耗1molNaClO2产生ClO2的物质的量为mol;产生CO2的化学方程式为。
化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是( )
A . 以食盐、氨、二氧化碳为原料制取碳酸钠
B . 以软锰矿、浓盐酸为原料制取氯气
C . 用  溶液刻蚀铜制印刷电路板
D . 从海水中提取粗盐
溶液刻蚀铜制印刷电路板
D . 从海水中提取粗盐
 溶液刻蚀铜制印刷电路板
D . 从海水中提取粗盐
溶液刻蚀铜制印刷电路板
D . 从海水中提取粗盐
关于漂粉精的说法错误的是( )
A . 工业上用氯气与石灰乳反应制备
B . 漂粉精在空气中会变质
C . 漂粉精的有效成分是Ca(ClO)2与CaCl2
D . 漂粉精溶液有碱性与强氧化性
下列物质没有漂白作用的是( )
A . NaClO
B . SO2
C . CaCl2
D . H2O2
下列关于氯的说法正确的是( )
A . 1mol氯气与NaOH反应转移2mol电子
B . 35Cl、37Cl为不同的原子,化学性质不同
C . 氯水久置后pH值减小,漂白性减弱
D . 干燥的氯气不能使鲜花褪色
最近更新
 +2H+=H2O+CO2↑
+2H+=H2O+CO2↑


