第三章 铁 金属材料 知识点题库
目前流通的第五套人民币硬币材料分别为:1元硬币为铜芯镀镍合金,5角硬币为铜芯镀铜合金,1角硬币为硬铝合金.请回答:(题目中的百分含量均为质量分数)

-
(1) 钢是含碳量为0.03%~2%的(填物质类别名称).
-
(2) 如图所示的装置中,甲、乙、丙三个烧杯分别盛放足量的溶液,电极及溶液如下表所示:
电极
a
b
c
d
e
f
石墨
石墨
铜
钢
钢
铜
溶液
NaCl溶液
CuSO4溶液
CuSO4溶液
通电后电极a上可产生能使湿润的碘化钾淀粉试纸变蓝的气体.
①上述装置中M极为直流电源的 极(填“正”或“负”),电极b上发生的电极反应式为 .
②若在钢币上镀铜,应选择 烧杯(填“乙”或“丙”),当电极a上生成标准状况下气体2240mL时,理论上可在电极 (填字母)上镀铜 g.
-
(3) 工业上以铝土矿(主要成分Al2O3•nH2O,含少量的氧化铁和石英等杂质)为原料生产铝.为除去铝土矿样品中氧化铁和石英杂质,要将粉碎、筛选后的铝土矿样品溶解在足量的氢氧化钠溶液中处理,请写出有关反应的离子方程式 .
-
(4) 已知硬铝中含Cu:2.2%~5%、Mg:0.2%~3%、Mn:0.3%~1.5%、Si:0.5%,其余是Al.1角硬币单枚质量为2.20克,若想制得1角硬币1百万枚,理论上至少需要含Al2O3 90%的铝土矿约 吨(小数点后保留一位数字).
下列说法正确的是( )
A . 1mol任何气体的体积都约为22.4L
B . 22.4L水在标况下的质量为18g
C . 2L 1mol/L Na2CO3溶液中Na+浓度为4mol/L
D . 从1L NaCl溶液中取出100mL,其浓度与原1L溶液相同
下列变化不能通过一步反应直接完成的是( )
A . Al→AlO2﹣
B . CO2→HCO3﹣
C . SiO2→H2SiO3
D . SO2→H2SO3
某合作学习小组讨论辨析以下说法,正确的是( )
①粗盐和酸雨都是混合物;
②石油和水蒸气都是不可再生能源;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦牛奶和雾都是胶体.
A . ①②③④
B . ①③④⑦
C . ①③④⑤⑦
D . ①②⑤⑥
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 铝可以分别和NaOH溶液、盐酸反应 | 铝既有金属性又有非金属性 |
B | Na2CO3可以制胃药 | Na2CO3可以和盐酸反应 |
C | 硬铝是合金 | 其熔点比金属铝的熔点高 |
D | Na2O2具有强氧化性 | Na2O2可以作为漂白剂 |
A . A
B . B
C . C
D . D
在盛有1mL 1mol•L﹣1AlCl3溶液的试管中加入2mL10%的NH4F溶液,再加入1mL 3mol•L﹣1氨水,没有生成白色沉淀,其原因是( )
A . 溶液的碱性太弱
B . Al3+不与氨水反应
C . 生成的Al(OH)3溶解了
D . Al3+几乎都与F﹣结合生成了新物质
下列选项中能表示阿伏加德罗常数数值的是( )
A . 1 mol H+含有的电子数
B . 标准状况下,22.4 L酒精所含的分子数
C . 1.6 g CH4含有的质子数
D . 1 L 1 mol·L-1的硫酸钠溶液所含的Na+数
物质的量相同的二氧化硫和三氧化硫所含氧原子的个数比为( )
A . 3∶2
B . 2∶3
C . 4∶5
D . 5∶4
下列是五种物质的化学式,请按要求选择合适的序号填空:
A.NaHCO3 B.Na2CO3 C.Fe2O3 D.Ca(ClO)2 E. KAl(SO4)2·12H2O
-
(1) 俗称铁红的物质;
-
(2) 一种常见净水剂;
-
(3) 常用于焙制糕点的小苏打;
-
(4) 制普通玻璃的原料是石英、石灰石和。
下列反应能发生并用于化工生产的是( )
A . 制盐酸:Cl2+H2  2HCl
B . 制取镁:MgCl2(溶液)
2HCl
B . 制取镁:MgCl2(溶液)  Mg+Cl2
C . 制乙烯:C2H5OH
Mg+Cl2
C . 制乙烯:C2H5OH 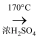 CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O
CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O 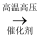 C2H5OH
C2H5OH
 2HCl
B . 制取镁:MgCl2(溶液)
2HCl
B . 制取镁:MgCl2(溶液)  Mg+Cl2
C . 制乙烯:C2H5OH
Mg+Cl2
C . 制乙烯:C2H5OH 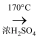 CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O
CH2=CH2+H2O
D . 制乙醇:CH2=CH2+H2O 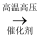 C2H5OH
C2H5OH
下列氯化物中既能由单质直接化合制得,又可由金属和盐酸反应制得的是( )
A . FeCl3
B . FeCl2
C . CuCl2
D . AlCl3
下列有关物质性质与用途具有对应关系的是( )
A . NH3具有还原性,可用作制冷剂
B . Si熔点高硬度大,可用于制半导体
C . Fe2(SO4)3具有氧化性,可用作净水剂
D . Al(OH)3具有弱碱性,可用于制胃酸中和剂
下图是某同学设计的一个电化学装置的示意图。

-
(1) 写出通入CH3OH的电极的电极反应式: 。
-
(2) 向乙池两电极附近滴加适量紫色石蕊试液,附近先变红的电极为极(填“A”或“B”),乙池中总反应的离子方程式: 。
-
(3) 当乙池中B(Ag)极的质量增加5.40 g时,乙池的pH是(若此时乙池中溶液的体积为500 mL);此时丙池某电极析出1.60 g某金属,则丙中的某盐溶液可能是(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
FeSO4在工业上可用于制备FeCO3 , 实验室模拟工业流程如图所示。下列说法正确的是( )
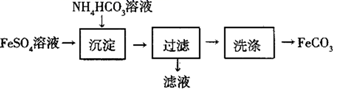
A . 可用KSCN溶液检验FeSO4溶液中Fe2+是否全部被氧化成Fe3+
B . 用Na2CO3代替NH4HCO3 , 可能有Fe(OH)2沉淀产生
C . 沉淀的同时有NH3产生
D . 检验沉淀是否洗涤干净,可用盐酸检验
电解精制饱和食盐水的离子方程式为。实验室中模拟上述实验,阳极产物是。若在标准状况下,电解200mL饱和食盐水,两极共收集到气体体积为33.6L(忽略溶液体积变化),则溶液中c(NaOH)为。
下列实验操作能达到实验目的的是( )

A . 用如图仪器和98%的硫酸( 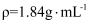 )配制60mL约
)配制60mL约  溶液
B . 向热的
溶液
B . 向热的 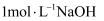 溶液中滴加2滴饱和
溶液中滴加2滴饱和  溶液,可制得
溶液,可制得 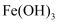 胶体
C . 向2%稀氨水中滴加过量的2%
胶体
C . 向2%稀氨水中滴加过量的2% 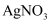 溶液,可以配成银氨溶液
D . 用玻璃棒蘸取
溶液,可以配成银氨溶液
D . 用玻璃棒蘸取  溶液点在湿润的pH试纸上,测定该溶液的pH
溶液点在湿润的pH试纸上,测定该溶液的pH
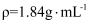 )配制60mL约
)配制60mL约  溶液
B . 向热的
溶液
B . 向热的 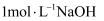 溶液中滴加2滴饱和
溶液中滴加2滴饱和  溶液,可制得
溶液,可制得 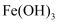 胶体
C . 向2%稀氨水中滴加过量的2%
胶体
C . 向2%稀氨水中滴加过量的2% 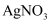 溶液,可以配成银氨溶液
D . 用玻璃棒蘸取
溶液,可以配成银氨溶液
D . 用玻璃棒蘸取  溶液点在湿润的pH试纸上,测定该溶液的pH
溶液点在湿润的pH试纸上,测定该溶液的pH
NA为阿伏加德罗常数的值,下列说法正确的是( )
A .  溶液中含有NA个
溶液中含有NA个  B . 常温常压下,22.4 L
B . 常温常压下,22.4 L  中含有NA个
中含有NA个  分子
C . 5.6g铁与过量
分子
C . 5.6g铁与过量  完全反应转移电子数为0.2NA
D . 16 g
完全反应转移电子数为0.2NA
D . 16 g  中含有4NA个C—H键
中含有4NA个C—H键
 溶液中含有NA个
溶液中含有NA个  B . 常温常压下,22.4 L
B . 常温常压下,22.4 L  中含有NA个
中含有NA个  分子
C . 5.6g铁与过量
分子
C . 5.6g铁与过量  完全反应转移电子数为0.2NA
D . 16 g
完全反应转移电子数为0.2NA
D . 16 g  中含有4NA个C—H键
中含有4NA个C—H键
将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2 , 红色也褪去。以下推测肯定错误的是( )
A . ①中红色褪去的原因是KMnO4将SCN-氧化
B . ②中红色褪去的原因是SO2将Fe3+还原成Fe2+
C . ②中红色褪去的原因是SO2将SCN-还原
D . SCN-在适当条件下可失去电子被氧化为(SCN)2
将某难溶于水的含铁化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量的氯水,溶液立即呈红色,该化合物是( )
A . Fe2O3
B . FeCl3
C . FeSO4
D . FeO
将29.4g Na与 的混合物投入足量水中,充分反应后水溶液增重29.2g,则原混合物中Na与
的混合物投入足量水中,充分反应后水溶液增重29.2g,则原混合物中Na与 的物质的量之比是( )
的物质的量之比是( )
 的混合物投入足量水中,充分反应后水溶液增重29.2g,则原混合物中Na与
的混合物投入足量水中,充分反应后水溶液增重29.2g,则原混合物中Na与 的物质的量之比是( )
的物质的量之比是( )
A . 1∶2
B . 2∶1
C . 2∶3
D . 3∶2
最近更新



