第三章 铁 金属材料 知识点题库
为了检验某FeCl2溶液是否变质,可选用的试剂是( )
A . Fe粉
B . Na2S溶液
C . KSCN溶液
D . 石蕊试液
合金具有优良的机械性能,用途广泛.下列物质不属于合金的是( )
A . 黄铜
B . 不锈钢
C . 紫铜
D . 生铁
氯化铝可制备无机高分子混凝剂,在有机合成中有广泛的用途.
完成下列填空:
-
(1) 实验室配制氯化铝溶液时加入盐酸的目的是.
-
(2) 往AlCl3溶液中加入过量下列溶液,最终得到无色澄清溶液的是(选填编号).
a.Na2CO3b.NaOHc.NaAlO2d.H2SO4
-
(3) 用滴管向试管中滴加少量AlCl3溶液时,滴管不得伸入试管中的理由是用试管夹夹持上述试管在酒精灯上加热时,不断上下移动试管的目的是.取AlCl3溶液,用小火持续加热至水刚好蒸干,生成白色固体的组成可表示为: Al2(OH)nCl(6﹣n) , 为确定n的值,取3.490g白色固体,全部溶解在0.1120mol 的HNO3(足量)中,并加水稀释成100mL,将溶液分成两等份,进行如下实验:
-
(4) 一份与足量氨水充分反应后过滤、洗涤、灼烧,最后得Al2O3的质量为1.020g.判断加入氨水已足量的操作是.过滤、洗涤后至少要灼烧次(填写数字);测定样品中铝元素含量时不选择测定干燥Al(OH)3的质量,而是测定Al2O3的质量的原因可能是(选填编号).
a.干燥Al(OH)3固体时易失水 b.Al2O3的质量比Al(OH)3大,误差小
c.沉淀Al(OH)3时不完全d.灼烧氧化铝时不分解
-
(5) 从另一份溶液中取出20.00mL,用0.1290mol/L的标准NaOH溶液滴定过量的硝酸,滴定前滴定管读数为0.00mL,终点时滴定管液面(局部)如图所示(背景为白底蓝线的滴定管).则滴定管的读数 mL,Al2(OH)nCl(6﹣n)中n的值为.

下列说法正确的是( )
A . 摩尔是国际单位制中的7 个基本物理量之一
B . 硫酸的摩尔质量是98 g
C . 0.5molH2 约含有3.01×1023个氢原子
D . NA个氧气分子与NA 个氢气分子的质量比为16:1
标准状况下,112mL某气体的质量为0.14g,则其摩尔质量为.
填空
-
(1) 氮原子的摩尔质量是,1mol HNO3的质量是,1mol HNO3约含有个氧原子.
-
(2) 标准状况下11.2L HCl的物质的量是.将这些气体溶于水中配成1L溶液,所得盐酸的物质的量浓度是.
-
(3) 2mol OH﹣含有的电子数为.
标准状况下,112mL某气体的质量是0.17g,该气体可能是( )
A . O2
B . N2
C . H2S
D . CO2
某溶液中含有Cl﹣、SO  、Fe3+、K+、M,且离子的物质的量之比为2:3:1:3:1,则微粒M为( )
、Fe3+、K+、M,且离子的物质的量之比为2:3:1:3:1,则微粒M为( )
 、Fe3+、K+、M,且离子的物质的量之比为2:3:1:3:1,则微粒M为( )
、Fe3+、K+、M,且离子的物质的量之比为2:3:1:3:1,则微粒M为( )
A . Na+
B . S2﹣
C . Mg2+
D . Ba2+
下列实验的操作和结论正确的是( )
A . 将0.1mol Na和少量Al片放入水溶液中,放出气体刚好是0.05mol
B . Na2O2投入到FeCl2溶液中只得到大量白色沉淀
C . 镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉
D . 配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大
化学是材料科学发展的基础.请回答:
-
(1) 合金在生活中的应用很普遍,其优点是,常见的合金有.
-
(2) 金属的腐蚀使我们生活中常看到的现象.家用铁锅洗后容易生锈,请举出一种避免生锈的办法.
-
(3) 服用药物时要对症下药.以碳酸氢钠为主要成分的药物适合治疗.
-
(4) 蛋白质是生命的基础,没有蛋白质就没有生命.蛋白质的基石是.常利用(填“盐析”“变性”或“颜色反应”)分离、提纯蛋白质.
以下物质间的每步转化不能通过一步反应就能实现的是( )
A . Al2O3→Al(OH)3→NaAlO2
B . MgCl2→Mg→Mg3N2
C . S→SO2→H2SO4
D . NaCl→Cl2→FeCl2
-
(1) 0.1L K2SO4和MgSO4的混合溶液中,含Mg2+ 2.4g,SO42﹣的物质的量浓度为1.5mol/L,求MgSO4和K2SO4的物质的量浓度?
-
(2) 常温下,将20.0g质量分数为14.0%的KNO3溶液与30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g/cm3的混合溶液.计算:
①混合后溶液的质量分数.
②混合后溶液的物质的量浓度.
③在1000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
-
(1) 0.3mol NH3分子中所含原子数与个H2O分子中所含原子数相等。
-
(2) 在9.5g某二价金属的氯化物中含有0.2mol Cl- , 该金属元素的相对原子质量为。
-
(3) 在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g,此混合物中C和O原子个数比是 。
下列物质间的转化能一步实现的是( )
A . NaNO3→NaCl
B . CO2→H2CO3
C . Fe2O3→Fe(OH)3
D . CaCO3→Ca(OH)2
下列关于物质用途的叙述中,不正确的是( )
A . 钾钠合金呈液态,可做快中子反应堆的导热剂
B . 硅酸钠俗称“水玻璃”,是制造水泥的原料
C . 硅是太阳能电池的常用材料
D . 氧化镁的熔点高达2800℃,是优质的耐高温材料
碱式氯化铜为绿色或墨绿色结晶性粉末,难溶于水,溶于稀酸和氨水,在空气中十分稳定。
-
(1) Ⅰ.模拟制备碱式氯化铜。向
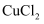 溶液中通入
溶液中通入  和
和  ,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。
,调节pH至5.0~5.5,控制反应温度于70~80℃,实验装置如图所示(部分夹持装置已省略)。 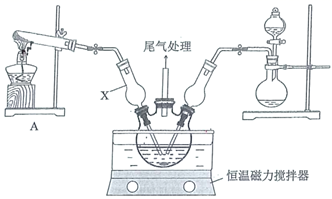
仪器X的名称是,其主要作用有导气、。
-
(2) 实验室利用装置A制
 ,发生反应的化学方程式为。
,发生反应的化学方程式为。
-
(3) 反应过程中,在三颈烧瓶内除观察到溶液蓝绿色褪去,还可能观察到的现象是、、。
-
(4) 若体系
 过高会导致碱式氯化铜的产量(填“偏高”、“偏低”或“无影响”)。
过高会导致碱式氯化铜的产量(填“偏高”、“偏低”或“无影响”)。
-
(5) 反应结束后,将三颈瓶中的混合物过滤,从滤液中还可以获得的副产品是(填化学式),经提纯得产品无水碱式氯化铜。
-
(6) Ⅱ.无水碱式氯化铜组成的测定。称取产品
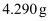 ,加硝酸溶解,并加水定容至200mL,得到待测液。
,加硝酸溶解,并加水定容至200mL,得到待测液。 铜的测定:取20.00mL测液,经测定,
 浓为
浓为 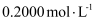 。则称取的样品中
。则称取的样品中  mol。
mol。 -
(7) 采用沉淀滴定法测定氯:用
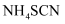 标准溶液滴定过量的
标准溶液滴定过量的  ,实验如图:
,实验如图: 
①滴定时,应选用下列哪种物质作为指示剂(填标号)。
A.
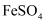 B.
B.  C.
C. 
②重复实验操作三次,消耗
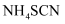 溶液的体积平均为10.00mL。则称取的样品中
溶液的体积平均为10.00mL。则称取的样品中 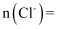 mol。
mol。 -
(8) 根据上述实验结果可推知无水碱式氯化铜的化学式为。
氯化铁是有机合成中常用的催化剂,如图是实验室模拟化工厂利用工业废铁屑(杂质不与盐酸反应)制备催化剂氯化铁的部分装置图,下列相关说法正确的是( )

A . 实验室也可以用装置甲制备SO2、C2H4
B . 实验过程中,应先让装置乙中的反应进行一段时间后,再开始装置甲中的反应
C . 实验过程中应该关闭弹簧夹3,让装置丙中的NaOH溶液充分吸收多余的Cl2
D . 反应结束后将三颈烧瓶中的溶液加热浓缩、冷却结晶,可制得氯化铁晶体
下列化学方程式或离子方程式书写正确的是( )
A . 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B . 向饱和NaOH溶液中通入过量CO2:2OH-+CO2=CO  +H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)
+H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)  Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO
Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO  =BaSO4↓
=BaSO4↓
 +H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)
+H2O
C . 铁与水蒸气反应:3Fe+4H2O(g)  Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO
Fe3O4+4H2
D . 向氢氧化钡溶液中滴加稀硫酸:Ba2++SO  =BaSO4↓
=BaSO4↓
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A . 10 g CaCO3和KHCO3的固体混合物所含阳离子大于0.1NA
B . 30 g二氧化硅中含有化学键的数目为NA
C . 1 mol Na被完全氧化生成Na2O,失去NA个电子
D . 1 L 1 mol/LCH3COONa溶液中含有CH3COO-的数目为NA
用NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A . H2O的摩尔质量等于1molH2O的质量
B . 28gN2和CO的混合气体中所含分子数是NA
C . 含有NA个氦原子的氦气在标准状况下的体积为11.2L
D . 0.5mol•L-1的NaCl溶液中Cl-的个数为0.5NA
最近更新



