第三章 铁 金属材料 知识点题库
下列有关铁及其化合物的说法中正确的是( )
A . 赤铁矿的主要成分是Fe3O4
B . 铁与水蒸气在高温下的反应产物为Fe2O3和H2
C . 除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D . Fe3+与KSCN溶液产生红色沉淀
已知某混和气体的体积百分组成中有80.0%的CH4、15.0%C2H2、5.0%的C2H4 , 请计算0.5摩尔该混和气体的质量和在标准状态下的密度(克/升).
标准状况下88gCO2有( )
A . 3NA个原子
B . NA个分子
C . 2.0mol分子
D . 11.2L
根据所学化学知识计算:
-
(1) 6.02×1022个Na+的物质的量为:.
-
(2) 3molH2O的质量为:.
-
(3) 同温同压下,同体积的CH4和CO2物质的量之比为; 分子个数之比;原子个数之比;质量比.
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A . 标准状况下,22.4L H2O含有的分子数为 NA
B . 通常状况下,NA 个CO2分子占有的体积为22.4L
C . 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl—个数为2NA
D . 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
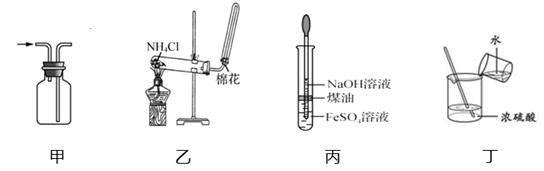
下列有关实验装置进行的相应实验,能达到实验目的的是( )
A . 用图甲所示装置收集 NO
B . 用图乙所示装置制备 NH3
C . 用图丙所示装置制备 Fe(OH)2
D . 用图丁所示装置稀释浓 H2SO4
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A . 密闭容器中2 mol NO与2 mol O2充分反应,体系中的原子总数为8 NA
B . 100 g质量分数为9.8%的硫酸水溶液中含氧原子的数目为0.4 NA
C . 0.1mol铁在0.1mol Cl2中充分燃烧,转移的电子数为0.3 NA
D . 常温下,0.1mol·L-1的Na2SO4溶液中含有的离子总数为0.3 NA
NA代表阿伏加德罗常数,下列说法正确的是( )
A . 标准状况下,11.2L酒精所含分子数为0.5NA
B . 40gNaOH含有氧原子数为NA
C . 22.4L O2所含的原子数目为NA
D . 标准状况下,22.4L氢气含有NA个氢原子
6.4gO2的物质的量是多少?含有多少个氧气分子?在标准状况下的体积是多少?
下列说法正确的是 



A . 摩尔是国际单位制中7个基本物理量之一
B . 阿伏加德罗常数等于6.02×1023个12C中含有的碳原子数
C . 物质的量是能把物质的质量和微观粒子数联系起来的一个物理量
D . 若一分子NO、N2O的质量分别为ag、bg,则N原子的摩尔质量是(b-a) g/mol
向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法不正确的是( )
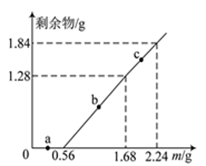
A . a点时溶液中阳离子为Cu2+、Fe2+和Fe3+
B . b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C . c点时溶液中溶质的物质的量浓度为0.5 mol·L-1
D . 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A . 标准状况下,11.2L三氯甲烷中含有分子数为0.5NA
B . 常温常压下,2gD2O中含有电子数为NA
C . 46gNO2和N2O4混合气体中含有原子数为3NA
D . 1 mol Na完全与O2反应生成Na2O和Na2O2 , 转移电子数为NA
请按要求填空做答。
-
(1) NaHCO3能用于治疗胃酸过多,反应的离子方程式为。
-
(2) 铁和水蒸气反应的化学方程式为3Fe+4H2O(g)
 Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
Fe3O4+4H2 , 该反应中84g Fe参加反应,转移电子的物质的量为。
-
(3) 制备Fe(OH)3的实验操作:向煮沸的蒸馏水中加入几滴FeCl3溶液,。
-
(4) 密度为1.84g/cm3 , 质量分数为98%的浓硫酸的物质的量浓度为。
化学与社会、生活密切相关。对下列现象或事实的解释正确的是( )
| 现象或事实 | 解释 | |
| A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | K2FeO4用于自来水的消毒和净化 | K2FeO4具有强氧化性,被还原后生成的Fe3+水解生成胶状物,可以软化硬水 |
| C | Na2O2用于呼吸面具中作为O2的来源 | Na2O2是强氧化剂,能氧化CO2生成O2 |
| D | 浸泡过KMnO4溶液的硅藻土可用于水果保鲜 | KMnO4溶液可氧化水果释放的CH2=CH2 |
A . A
B . B
C . C
D . D
下列关于古代化学的应用和记载的说明不合理的是( )
A . “司南之杓(勺),投之于地,其杓指南”,司南中“杓”的主要成分为Fe3O4
B . 苏轼的《格物粗谈》中记载“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”文中的“气”是指氧气
C . 《本草经集注》中记载鉴别硝石(KNO3)和朴消(Na2SO4)的方法:“强烧之,紫青烟起,云是真硝石也”,利用了焰色反应。
D . 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”是指传统无机非金属材料,主要成分为硅酸盐
要证明某溶液中不含Fe3+ , 而可能含有Fe2+ , 进行如下实验操作的最佳顺序为( )
①加入少量氯水 ②加入足量KMnO4 (H+)溶液 ③加入少量 KSCN溶液
A . ①③
B . ③②
C . ③①
D . ①②③
工业上用黄铁矿(FeS2)为原料制备硫酸的流程如下:

-
(1) 沸腾炉中发生反应的化学方程式为4FeS2+11O2
 2Fe2O3+8SO2 , 该反应被氧化的元素是(填元素名称)。
2Fe2O3+8SO2 , 该反应被氧化的元素是(填元素名称)。
-
(2) 利用Fe2O3废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的化学方程式为。
-
(3) 从接触室出来的混合气体中含有SO2、SO3、O2、N2等气体,设计一个实验方案证明其中含有SO2:。
-
(4) 有些反应中物质浓度不同,性质也不同。浓硫酸有三大特性:吸水性、脱水性、强氧化性。则加热时浓硫酸与木炭反应的化学方程式为。
-
(5) 将一定量锌与100mL18mol/L 浓硫酸充分反应后,若锌完全溶解同时产生气体0.8mol, 将反应后的溶液稀释得400mL,测得c(H+)=2mol/L,则产生气体中SO2 物质的量为mol。
下列叙述正确的是( )
A . Fe分别与氯气和稀盐酸反应所得氯化物相同
B . 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
C . 新制氯水可用于自来水的杀菌消毒
D . 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应
甲同学用FeCl2和烧碱制备Fe (OH) 2;乙同学用如图装置制备Fe (OH)2 , 为了生成的产物不容易被氧化,下列说法不正确的是( )
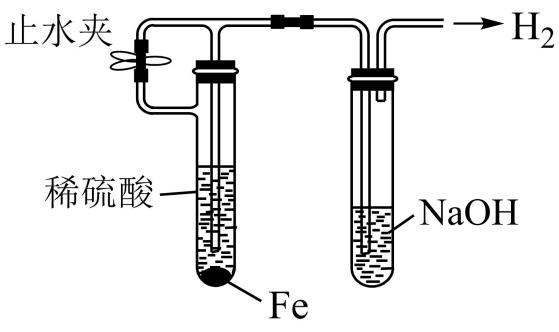
A . 配制溶液所用的蒸馏水通常要煮沸
B . 甲同学可在FeCl2溶液的上面加一层植物油,以隔绝空气
C . 甲同学向FeCl2溶液中滴加烧碱溶液时,胶头滴管尖嘴可以伸入到试管内
D . 乙同学应该先关闭止水夹,一段时间以后再打开止水夹
铁粉在弱酸性条件下去除废水中 的反应原理如下图。
的反应原理如下图。
 的反应原理如下图。
的反应原理如下图。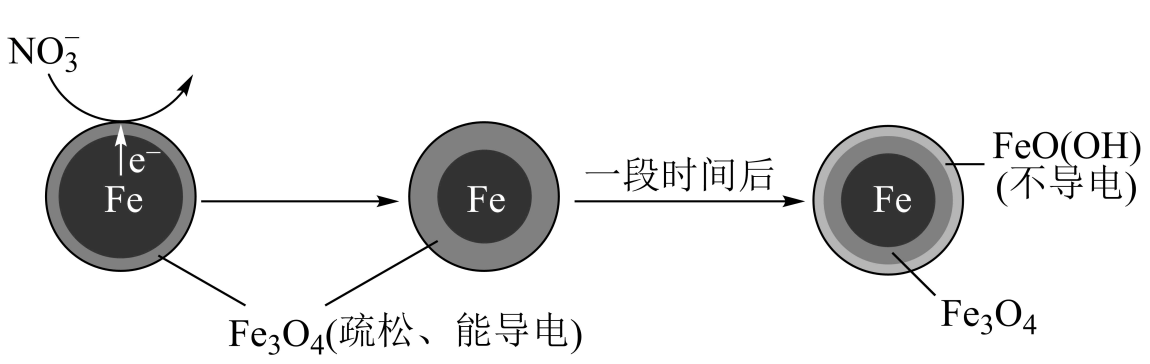
下列说法正确的是( )
A . 上述条件下加入的 能完全反应
B . 正极的电极反应式:
能完全反应
B . 正极的电极反应式: C .
C .  的产生与
的产生与 被氧化和溶液pH升高有关
D . 废水中溶解氧的含量不会影响
被氧化和溶液pH升高有关
D . 废水中溶解氧的含量不会影响 的去除率
的去除率
 能完全反应
B . 正极的电极反应式:
能完全反应
B . 正极的电极反应式: C .
C .  的产生与
的产生与 被氧化和溶液pH升高有关
D . 废水中溶解氧的含量不会影响
被氧化和溶液pH升高有关
D . 废水中溶解氧的含量不会影响 的去除率
的去除率
最近更新