第一节 铁及其化合物 知识点题库
X | Y | Z | |
A | Fe | FeCl3 | FeCl2 |
B | NH3 | NO | NO2 |
C | Na | NaOH | Na2CO3 |
D | S | SO3 | H2SO4 |

A | B | C | D |
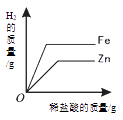
向一定量石灰石 中滴加稀盐酸 | 向一定量硫酸铜溶液 中不断加入铁粉 | 向足量盐酸中加 等质量的金属Zn、Fe | 向一定量过氧化氢溶液中加入少量二氧化锰 |
|
|
|
|
-
(1) 工业上由软锰矿(主要成分为MnO2)生产高锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4), 该反应的化学方程式是。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在 (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是。
-
(2) 某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含K2MnO4、MnO2及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
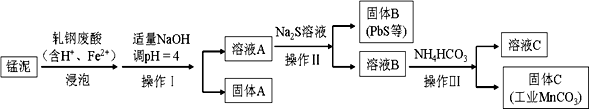
①轧钢废酸中Fe2+的作用是。
②操作I、操作Ⅱ、操作Ⅲ的名称是,
用到的玻璃仪器有。
③溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是。
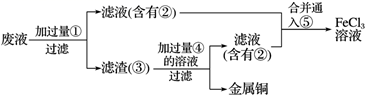
请回答下列问题。
-
(1) 实验室中,检验溶液中存在Fe3+的试剂是,证明Fe3+存在的现象是。
-
(2) 写出FeCl3溶液与金属铜发生反应的离子方程式:。
-
(3) 写出上述流程图中加入或生成的有关物质的化学式:①,②,④。
-
(4) 含有②的滤液与⑤反应的化学方程式为。
| 选项 | 实验操作和现象 | 实验结论 |
| A | 常温下,用pH计测定等物质的量浓度的NaHCO3、NaClO4两种盐溶液的pH,测得NaHCO3的pH大于NaClO4 | 非金属性:Cl>C |
| B | 向含有Na+、K+、NO | SO |
| C | 向某溶液中滴加氯水后在滴加KSCN溶液,溶液呈红色 | 溶液中一定含有Fe3+ |
| D | 向2mL 0.1mol/L Na2S溶液中滴入2mL0.1mol/LZnSO4溶液,再加入几滴0.1mol/L CuSO4溶液。开始有沉淀产生,后有黑色沉淀生成 | Ksp(CuS)>Ksp(ZnS) |

A的一种合金用量最大,用途最广。请回答下列问题:
-
(1) 在C中加入氢氧化钠溶液的现象:。
-
(2) B、H的化学式:B、H。
-
(3) Na2O2的电子式:。
-
(4) 写出鉴定E中阳离子的实验方法和现象:。
-
(5) 在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式:。
 B .
B . 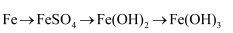 C .
C . 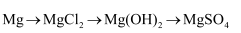 D .
D . 
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 将Cl2通入盛有湿润有色布条的集气瓶 | 有色布条褪色 | 说明氯气具有漂白性 |
| C | Al箔插到稀硝酸中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
 溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中
溶液的小烧杯中,过一段时间后,取出覆铜板,用水洗净并晾干(如图)。对反应后的溶液进行分析,溶液中 与
与 之比为2∶3。下列说法不正确的是( )
之比为2∶3。下列说法不正确的是( )

 B . 反应的离子方程式为:
B . 反应的离子方程式为: C . 反应后的溶液中:
C . 反应后的溶液中: D . 反应后的溶液再生为
D . 反应后的溶液再生为 :加入足量铁粉,过滤,滤液中通入足量
:加入足量铁粉,过滤,滤液中通入足量
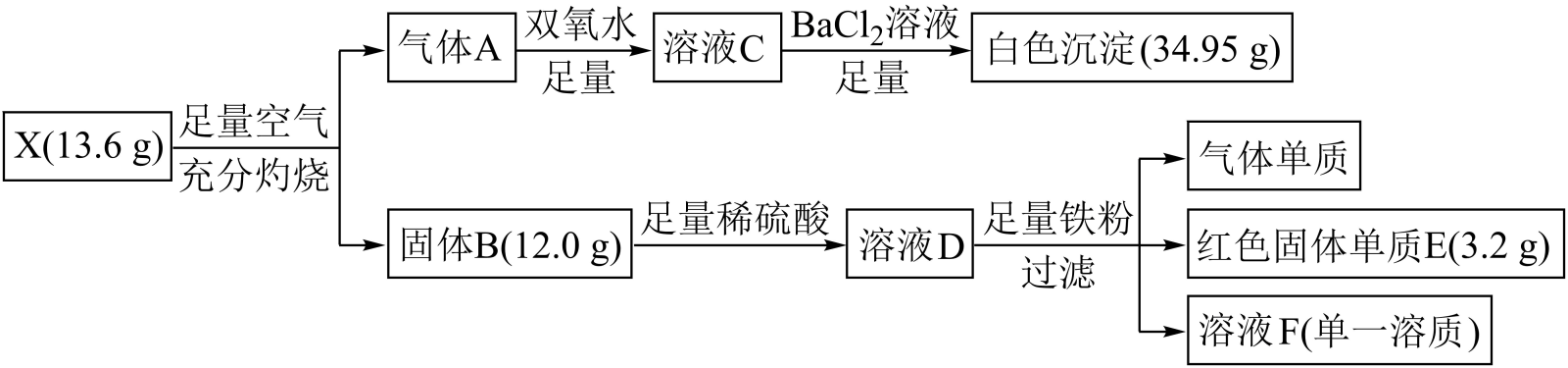
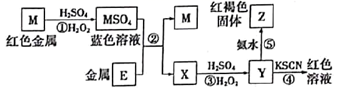
请回答:
-
(1) 溶液F的溶质为(写名称)。
-
(2) 组成X的三种元素是,X的化学式是。
-
(3) 写出气体A与溶液D反应的离子方程式。
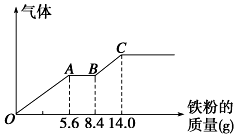
 C . C点之后的溶液中溶质只有
C . C点之后的溶液中溶质只有 D . 原混合溶液中
D . 原混合溶液中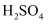 的浓度为1.5mol/L
的浓度为1.5mol/L
-
(1) ①
 的俗名;
的俗名;②写出漂白粉有效成分的化学式。
-
(2) ①请写出小苏打在水中的电离方程式:;
②氯化亚铁溶液中通入氯气的离子方程式:。
-
(3) ①写出高温下Fe与水蒸气反应的化学方程式:;
②写出金属钠与水反应的化学方程式:。



 、SO
、SO  的溶液中逐滴滴加盐酸,立即产生气泡
的溶液中逐滴滴加盐酸,立即产生气泡


