第一节 铁及其化合物 知识点题库

-
(1) 写出该反应的化学方程式 ,四氧化三铁是(填“氧化产物”还是“还原产物”) 。
-
(2) 加热烧瓶的作用是。
-
(3) 烧瓶底部放了几片碎瓷片,其作用是。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
-
(1) 实验1中产生白色沉淀的离子方程式是。
-
(2) 为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
① 甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3 , 方案是。
② 乙同学查阅文献:Fe(OH)2在大量SO42存在的情况下形成Fe6(SO4)2(OH)4O3(一种氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入,再往试管中加入,振荡,现象与实验1相同,结论是该假设不成立。
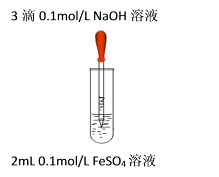
③ 乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10 mL
NaOH溶液
滴加
FeSO4溶液
实验现象
实验2
6 mol/L
NaOH溶液
0.2mol/L FeSO4溶液
产生悬浮于液面的白色沉淀(带有少量灰绿色) ,沉淀下沉后,大部分灰绿色变为白色沉淀
实验3
6 mol/L
NaOH溶液
0.1mol/L FeSO4溶液
产生悬浮于液面的白色沉淀(带有极少量灰绿色) ,沉淀下沉后,底部都为白色沉淀
该实验得出的结论是,能说明灰绿色是由Fe(OH)2表面吸附Fe2+引起的证据是。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是,证明该假设成立。
-
(3) 丙同学探究温度对氢氧化亚铁制备实验的影响:取少量灰绿色沉淀,在水浴中加热,颜色由灰绿变白,且有絮状白色沉淀下沉,原因为。
-
(4) 根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件。
 溶液中的少量
溶液中的少量  和
和 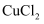 ,可行的方法是( )
,可行的方法是( )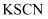 溶液
溶液
-
(1) Ⅰ.铁不能与冷、热水反应,但能与水蒸气反应,完成实验Fe与水蒸气的反应,如图所示。
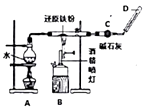
装置A的作用是;
-
(2) B中反应的化学方程式:;
-
(3) 碱石灰的作用是;
-
(4) 在D处玻璃管口点燃生成的气体前,必须对该气体进行,这一操作的目的是;
-
(5) 当有8.4g铁粉参加反应时,生成的气体在标准状况下的体积是L。
-
(6) Ⅱ.制备二氧化硫并研究其性质,如图所示。
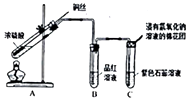
A中铜与浓硫酸反应的化学方程式是;
-
(7) B,C中的实验现象分别是、;
-
(8) 浸氢氧化钠溶液的棉花团的作用是,反应的离子方程式是。
-
(1) 现将少量Fe2O3粉末加入适量稀盐酸,发生反应的离子方程式,用所得溶液进行以下实验:
-
(2) 取少量溶液于试管中,滴入NaOH溶液,观察到有红褐色沉淀生成,反应的离子方程式为。
-
(3) 取少量溶液于试管中,加入少量还原铁粉,振荡,铁粉逐渐溶解,溶液由黄色变为浅绿色,反应的离子方程式为。
-
(4) 在烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中滴加几滴FeCl3饱和溶液,继续煮沸直到溶液呈红褐色,即得到Fe(OH)3胶体。取少量Fe(OH)3胶体,逐滴加入盐酸至过量,可观察到的现象是:先,然后,对后一现象的解释是(用离子方程式表示)。
-
(1) 如果固体完全溶解,则m最大值为。
-
(2) 如果溶液中Cu2+浓度为0.25 mol·L-1 , 则m值为。
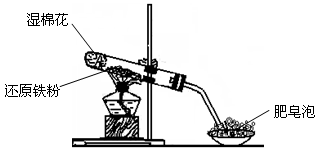
请回答下列问题:
-
(1) 硬质试管中发生反应的化学方程式为 。
-
(2) 该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分一定有,可能有,若溶液未变红色则说明硬质试管中固体物质的成分是。
-
(3) 该同学按上述实验方案进行了实验,结果溶液未变红色,原因是:(用离子方程式表示)。
-
(4) 该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出上述白色沉淀变成红褐色的化学方程式:

-
(5) 一段时间后,该同学发现(3)中未变红的溶液变成红色,
说明Fe2+ 具有性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是,并且配制含Fe2+的盐溶液时应加入少量。
①Fe与过量的S反应 ②Fe与过量稀硫酸反应后,再向其中加KNO3
③Fe(NO3)2溶液中加少量盐酸 ④Fe和Fe2O3的混合物溶于盐酸中
-
(1) 由FeCl3∙6H2O制得干燥FeCl2的过程如下:
i.向盛有FeCl3∙6H2O的容器中加入过量SOCl2(液体,易水解),加热,获得无水FeCl3。
ii.将无水FeCl3置于反应管中,通入一段时间的氢气后加热,生成FeCl2。
①FeCl3∙6H2O中加入SOCl2获得无水FeCl3的化学方程式为。(已知该反应为非氧化还原反应)
② ii中通入一段时间的氢气后再加热的目的是。
-
(2) 利用反应2FeCl3 + C6H5Cl
 2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去)
2FeCl2+ C6H4Cl2 +HCl↑,制取无水FeCl2。在三颈烧瓶中加入无水氯化铁和过量的氯苯,控制反应温度在一定范围内加热3 h,冷却、分离、提纯得到粗产品,实验装置如图。(加热装置略去) 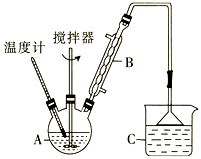
①仪器B的名称是 。反应前需向A中通入N2的目的是。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经、、干燥后,得到FeCl2粗产品。
③该装置存在的不足之处是。
-
(3) FeCl2的纯度测定。
①取a g样品配制成100 mL溶液;③用移液管移取所配溶液5.00mL,放入500 mL锥形瓶内并加水200mL;③往上述锥形瓶中加入硫酸锰溶液20.00 mL,用0.1 mol∙L-1酸性KMnO4标准溶液滴定,终点时消耗酸性KMnO4标准溶液V mL。滴定至终点的判断依据是。若所配溶液中ω(FeCl2)=kV(V为消耗的酸性高锰酸钾标准溶液的毫升数)g·L-1 , k=。

有关物质性质如下表
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,难溶于乙醇 |
| 两性化合物 | 强酸性、强还原性 |
实验过程:
I.合成:装置C中盛有31.8 g FeCO3和200 mL 2.0 mol·L-1甘氨酸溶液和适量柠檬酸。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌,并通过仪器b向C中加入适量氢氧化钠溶液调节pH到6左右,使反应物充分反应。
II.分离:反应结束后,过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
回答下列问题:
-
(1) 装置B盛装的试剂为;仪器b比a的优点是。
-
(2) 若想证明C装置中空气排净,则D中通常盛装的试剂为。
-
(3) 合成过程加入柠檬酸的作用是促进FeCO3溶解和。
-
(4) 加入氢氧化钠溶液调节pH若大于6,甘氨酸亚铁产量下降。原因可用离子方程式表示为。
-
(5) 检验产品中是否含有Fe3+的最佳试剂是。
-
(6) 本实验制得24.5 g甘氨酸亚铁,则其产率是%。

 、
、  、
、 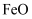 、
、  和一些有机物等杂质,其制备工艺流程如下:
和一些有机物等杂质,其制备工艺流程如下: 
已知:① 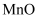 不溶于水,可溶于硫酸溶液②
不溶于水,可溶于硫酸溶液②  不溶于稀硫酸
不溶于稀硫酸
③ 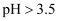 时,
时,  以
以 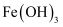 形式完全沉淀
形式完全沉淀
-
(1) 酸浸时,将纯橄岩粉碎的目的是。
-
(2) 酸浸时温度控制在
 ,可采用的合适加热方式是。
,可采用的合适加热方式是。
-
(3) 滤渣Ⅰ中的主要成分是,实验室中过滤操作所需玻璃仪器有烧杯、漏斗、。
-
(4) 加入
 溶液,可将滤液I中的
溶液,可将滤液I中的  氧化成
氧化成  ,同时也将
,同时也将  氧化成
氧化成  。生成
。生成  反应的离子方程式是。检验滤液Ⅱ是否还含有
反应的离子方程式是。检验滤液Ⅱ是否还含有  :取适量溶液于试管中,加入试剂
:取适量溶液于试管中,加入试剂  ,观察现象。X最好选择(填符合题意选项的字母编号)。
,观察现象。X最好选择(填符合题意选项的字母编号)。 A.
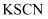 溶液 B.酸性
溶液 B.酸性  溶液 C.
溶液 C.  溶液
溶液 -
(5) 取10g洗净并已干燥的滤渣II,加入足量稀硫酸,充分反应后得4.65g固体,则滤渣II中铁元素的质量分数为。
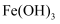 D . 指南针中因含有
D . 指南针中因含有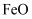 而可以指定方位
而可以指定方位