第二节 金属材料 知识点题库
汞合金是目前使用较多的补牙材料。英国《新科学家》杂志最近发表了一篇文章,对汞合金补牙材料的安全性提出了质疑。汞合金补牙材料中除水银外,还含锌、锡、铜等金属。下列有关汞合金的说法不正确的是( )
A . 汞合金是一种具有金属特性的化合物,易导热、导电
B . 汞合金的强度和硬度比锡的大
C . 汞合金的熔点比汞的高
D . 汞合金的毒性远低于汞的毒性
镁是一种很活泼的金属,常用作脱硫剂、脱氧剂.现在,某化学兴趣小组对金属镁的性质进行实验探究.他们首先在网络上查找到了一些关于金属镁的性质的方程式如下:
①2Mg+O2 2MgO;②3Mg+N2
2MgO;②3Mg+N2 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2 2MgO+C
2MgO+C
④Mg+H2O MgO+H2↑;⑤Mg3N2+6H2O
MgO+H2↑;⑤Mg3N2+6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
完成下列填空:
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).实验装置如下(部分夹持仪器省略).
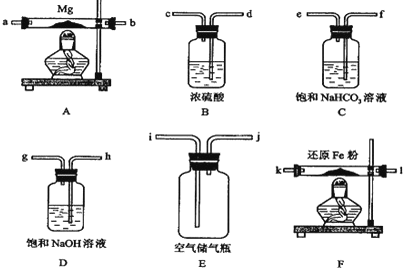
-
(1) 装置F的作用是 .通气后,如果同时点燃A、F装置的酒精灯,对实验结果的影响是 ,产生这一现象的原因是 .
-
(2)
请设计一个实验,验证产物是氮化镁: .
镁在电子工业中利用镁制取硅的反应为:2Mg+SiO2
 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si
Mg2SiMg2Si遇盐酸迅速反应生成SiH4(硅烷).SiH4在常温下是一种不稳定、易分解的气体.
-
(3) 图(甲)是进行Mg与SiO2反应的实验装置.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用①CO2、②N2、③H2中的 (选填编号).实验开始时,必须先通入X的气体,再接通电源加热反应物,其理由是 ;当反应引发后,切断电源,反应能继续进行,其原因是 .
-
(4) 图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为 .停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯.橡胶气胆B在实验中的作用是 .C中全部反应产物有 (填化学式).
在标准状况下,O2与H2的密度之比为( )
A . 4:1
B . 8:1
C . 32:1
D . 16:1
相同状况下的12C18O和14N2两种气体,下列说法正确的是( )
A . 若分子数相等,则体积相等
B . 若原子数相等,则中子数相等
C . 若质量相等,则质子数相等
D . 若体积相等,则质量数相等
下列各组物质混合后,再加热蒸干并在300℃时充分灼烧至质量不变,最终一定能得到纯净物的是( )
A . 向FeSO4溶液中通入过量Cl2
B . 向NaHCO3溶液中加入一定质量的Na2O2粉末
C . 向NaI和NaBr混合溶液中通入过量Cl2
D . 向NaOH溶液中加入过量AlCl3(SO4)3
在150℃时,加热高氯酸铵固体发生分解反应:2NH4ClO4=N2+Cl2+2O2+4H2O,其气态生成物组成的混合气的平均式量为( )
A . 40.75
B . 29.38
C . 14.69
D . 无法计算
有五种化合物:①Mg(HSO3)2 , ②Al(OH)3 ③Na[Al(OH)4], ④(NH4)2CO3 , ⑤Al2O3。跟盐酸和NaOH溶液都反应的是( )
A . ②④
B . ①②③
C . ①②④⑤
D . ③④⑤
化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是( )
A . 氢气与过量的碘蒸气(500℃)
B . 铝片与过量浓硝酸(常温)
C . 铜粉与过量浓硝酸(常温)
D . 浓硫酸与过量铜片(共热)
下列物质转化在给定条件下每一步都能实现的是()
A . Si  SiO2
SiO2 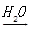 H2SiO3
B . Mg(OH)2
H2SiO3
B . Mg(OH)2  MgCl2(aq)
MgCl2(aq) 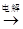 Mg
C . Al2O3
Mg
C . Al2O3  AlCl3(aq)
AlCl3(aq) 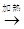 无水AlCl3
D . CH3CHO
无水AlCl3
D . CH3CHO 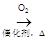 CH3COOH
CH3COOH  CH3COOCH3
CH3COOCH3
深入研究碳元素的化合物有重要意义,回答下列问题:
-
(1) 在恒温、恒容密闭容器中加入H2C2O4 , 发生反应:H2C2O4(s)
 CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A . 压强不再变化 B . CO2(g)的体积分数保持不变 C . 混合气体的密度不再变化 D . 混合气体的平均摩尔质量保持不变
CO2(g)+CO(g)+H2O(g),下列叙述能说明反应已经达到平衡状态的是________。
A . 压强不再变化 B . CO2(g)的体积分数保持不变 C . 混合气体的密度不再变化 D . 混合气体的平均摩尔质量保持不变 -
(2) 工业上可以通过反应CO(g)+2H2(g)
 CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2 , CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)v逆(CH3OH)(填“>”、“<”或“=”)。若在压强p1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2 , 则在压强p2下达到平衡状态B时容器的体积V(B)=L。
CH3OH(g)制备甲醇。在一容积可变容器中充入2molCO和4molH2 , CO的平衡转 化率随温度(T)、压强(P)的变化关系如图所示。该反应的∆H0(填“>”、“<”或“=”),比较A点时用CO表示的正反应速率与B点时用CH3OH表示的逆反应速率的大小v正(CO)v逆(CH3OH)(填“>”、“<”或“=”)。若在压强p1下达到化学平衡状态A时,容器的体积为10L。如果反应开始时仍充入2molCO和4molH2 , 则在压强p2下达到平衡状态B时容器的体积V(B)=L。 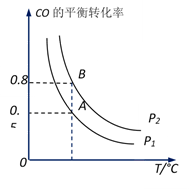
-
(3) 从平衡移动的角度分析AlCl3溶液可以溶解CaCO3固体的原因是
-
(4) 常温下,测得某CaCO3的饱和溶液pH=10.0,忽略CO32-的第二步水解,计算Ksp(CaCO3)=(保留三位有效数字)(已知:Ka1(H2CO3)=4.4×10-7Ka2(H2CO3)=4.7×10-11)
-
(5) 有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且用含Na+的导电固体作为电解质,已知该电池的正极反应式为2Na++FeS+2e-=Na2S+Fe, 则放电时负极反应式为。该电池充电时,当转移2mol电子时,阳极质量的变化量为g。
取4.6克的钠投入水中,完全反应后问:
-
(1) 生成的气体体积在标准状态下为多少升?
-
(2) 生成的溶质的质量是多少?
在标准状况下,如果V升氯化氢中有n个原子,则阿伏加德罗常数为( )
A . 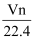 B .
B .  C .
C . 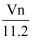 D .
D . 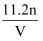
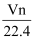 B .
B .  C .
C . 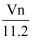 D .
D . 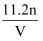
葡萄糖可发生如下转化:2CH3CH(OH)COOH(乳酸)  C6H12O6(葡萄糖)
C6H12O6(葡萄糖)  2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
 C6H12O6(葡萄糖)
C6H12O6(葡萄糖)  2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 常温常压下,6.0g葡萄糖和乳酸混合物中氧原子数0.2NA
B . 1mol葡萄糖中含有6.0NA个羟基
C . 1mol乳酸与足量乙醇反应可生成NA个乳酸乙酯分子
D . 相同条件下,相同物质的量的乳酸分别与足量的Na和NaHCO3溶液反应,产生气体的分子数均为NA
已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A . 44.0 g环氧乙烷中含有7.0NA个极性键
B . 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA
C . 将标准状况下 224 mL SO2溶于水制成 100 mL溶液,H2SO3、  、
、  三者数目之和为0.01 NA
D . 4.6 g 14CO2与N218O的混合物中所含中子数为2.4NA
三者数目之和为0.01 NA
D . 4.6 g 14CO2与N218O的混合物中所含中子数为2.4NA
 、
、  三者数目之和为0.01 NA
D . 4.6 g 14CO2与N218O的混合物中所含中子数为2.4NA
三者数目之和为0.01 NA
D . 4.6 g 14CO2与N218O的混合物中所含中子数为2.4NA
在标准状况下进行甲、乙、丙三组实验:各取 30
mL 同浓度的盐酸,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量(g) |
0.255 |
0.385 |
0.459 |
|
生成气体体积(mL) |
280 |
336 |
336 |
试回答:
-
(1) 盐酸的物质的量浓度为 mol·L-1。
-
(2) 镁 、铝的物质的量之比为。
石墨烯是具有单层片状结构的新材料(如图),其厚度仅有一个原子直径大小(约0.35nm),可覆盖于金属表面,用于金属防腐。下列说法错误的是( )

A . 所有金属腐蚀都是金属失去电子
B . 一般环境中,金属腐蚀的正极反应式:O2+2H2O+4e-=4OH-
C . 石墨烯防腐的原理是形成了性质稳定的合金
D . 石墨烯防腐的缺点是一旦破损就会加速金属的腐蚀
实验室中利用固体KMnO4进行如图实验,下列说法错误的是( )
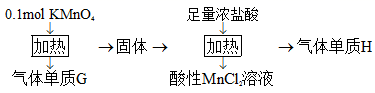
A . G与H均为氧化产物
B . 实验中KMnO4只作氧化剂
C . Mn元素至少参与了3个氧化还原反应
D . G与H的物质的量之和可能为0.25mol
下列实验操作、现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 将Cl2通入盛有湿润有色布条的集气瓶 | 有色布条褪色 | 说明氯气具有漂白性 |
| C | Al箔插到稀硝酸中 | 无现象 | Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
A . A
B . B
C . C
D . D
下列物质中所含分子的物质的量最多的是( )
A . 1.5 mol O2
B . 56g N2
C . 33.6LCl2(标准状况)
D . 3.01×1023个SO2分子
铝,氧化铝,氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )
A . 都有水生成
B . 都有氢气生成
C . 都有偏铝酸根生成
D . 都有三价铝离子生成
最近更新



