第二节 金属材料 知识点题库
某物质M是一种镁基储氢材料.现取84g M在高温条件下加热分解,得到0.5mol固态化合物A(只含有二种短周期元素)和44.8L气体B(气体体积为标准状况下),该气体能使湿润的红色石蕊试纸变蓝.固态化合物A极易与水反应,又有气体B产生.
物质B有如下转化关系:B C
C D
D E,E是一种强酸.请回答下列问题:
E,E是一种强酸.请回答下列问题:
(1)物质A的化学式为 ,属于 晶体(填“分子”、“离子”、“原子”等).
(2)写出M高温分解的化学方程式 .
(3)将C和D的混合物溶解在接近零度的水中,即可得到一种弱酸F的水溶液.弱酸F比醋酸酸性稍强,很不稳定,通常在室温下易分解.要制得F溶液,可以往冷冻的其钠盐浓溶液中加入或通入某种物质,下列物质不适合使用的是 (填序号).
a.盐酸 b.二氧化碳 c.稀硫酸 d.二氧化硫
(4)现发现一种活性很强的离子化合物G,其组成为NH5 , 电子式为  ,NH5与水反应能否产生H2 (填“能”与“否”),理由是 .
,NH5与水反应能否产生H2 (填“能”与“否”),理由是 .
(5)现有9.6g镁与极稀的E溶液充分反应无气体产生,加入足量的NaOH溶液并微热,生成B气体(标准状况下) L.
-
(1) 实验室制氯气:
-
(2) 氧化铝与氢氧化钠溶液的反应:
-
(3) 铜与稀硝酸的反应:
-
(4) 碳与浓硫酸的反应:
-
(5) 铜投入三氯化铁溶液中:.
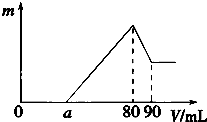
-
(1) )80~90mL对应反应的离子方程式.
-
(2) 金属铝的质量为
-
(3) 盐酸的体积是mL.
-
(4) a的取值范围是.
-
(5) n(Mg)/n(Al)的最大值是.
-
(1) 其中,属于电解质的是,属于非电解质的是,既不是电解质也不是非电解质的是。(本小题均用序号作答)
-
(2) 上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为。
-
(3) 17.1g ⑩ 溶于水配成250mL溶液, SO42-的物质的量浓度为mol/L。
| 选项 | 陈述I | 陈述II |
| A | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| B | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |

-
(1) 该盐酸的物质的量浓度;
-
(2) 标准状况下,该反应生成的气体的体积。
 B .
B .  C .
C .  D .
D . 
 B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是
B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是  mol
D . Wg该镁原子所含质子数是
mol
D . Wg该镁原子所含质子数是 
①它们所含的分子数目之比为1∶1
②它们所含的O原子数目之比为1∶2
③它们所含的原子总数目之比为3∶4
④它们所含的H原子数目之比为1∶1
⑤它们所含的电子数目之比为5∶9
①钠与水反应生成NaOH 和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物KCl的焰色为紫色;K2CO3的焰色也为紫色
④钠钾合金的熔点应介于Na和K熔点之间



