第二节 金属材料 知识点题库
关于金属元素在自然界存在的情况的叙述中,正确的是( )
A . 金属元素仅存在于矿物中
B . 金属元素存在于矿物和动物体內,但植物体內不含
C . 少数金属元素以游离态存在,大多数金属元素以化合态存在
D . 金属元素仅存在矿物中,动物和植物体內不存在金属元素
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
Na | Cu | Al | Fe | |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点(℃) | 883 | 2595 | 2200 | 3000 |
你判断其中不能形成合金的是( )
A . Cu和Al
B . Fe和Cu
C . Fe和Na
D . Al和Na
在 200mL 0.5mol/L H2SO4 溶液中,c(H+)=,溶质的质量是.此溶液中含 n(H+)=.
铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:下列说法中错误的是( )
![]()
A . ①②中除加试剂外,还需要进行过滤操作
B . a、b中铝元素的化合价不相同
C . ③中需要通入过量的CO2
D . ④进行的操作是加热,而且d一定是氧化铝
同温同压下,等质量的CO和CH4分别在足量的O2中完全燃烧,消耗O2的体积分别为xL和yL,则x与y的比值为( )
A . 1:4
B . 4:7
C . 1:7
D . 7:1
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )
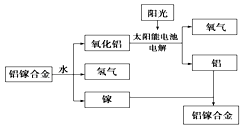
A . 铝镓合金与水反应的化学方程式为2Al+3H2O  Al2O3+3H2↑
B . 总反应式为2H2O
Al2O3+3H2↑
B . 总反应式为2H2O  2H2↑+O2↑
C . 该过程中,能量的转化形式只有两种
D . 铝镓合金可以循环使用
2H2↑+O2↑
C . 该过程中,能量的转化形式只有两种
D . 铝镓合金可以循环使用
 Al2O3+3H2↑
B . 总反应式为2H2O
Al2O3+3H2↑
B . 总反应式为2H2O  2H2↑+O2↑
C . 该过程中,能量的转化形式只有两种
D . 铝镓合金可以循环使用
2H2↑+O2↑
C . 该过程中,能量的转化形式只有两种
D . 铝镓合金可以循环使用
下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3④Al ⑤Na2CO3 .
A . ③④
B . ①②③④
C . ②③④
D . 全部
在60g碳中,所有碳原子的质子的总数约为 个.
进行下列反应后,所得溶液中一定只含有一种溶质的是( )
A . 将铁粉加到稀硝酸中
B . 向稀盐酸中滴入少量的NaAlO2溶液
C . 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液
D . NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液
在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A . H2SiO3  SiO2
SiO2  SiCl4
B . 浓HCl
SiCl4
B . 浓HCl 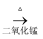 Cl2
Cl2 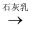 漂白粉
C . Fe
漂白粉
C . Fe  Fe2O3
Fe2O3  FeCl3
D . Mg(OH)2
FeCl3
D . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  无水MgCl2
无水MgCl2
 SiO2
SiO2  SiCl4
B . 浓HCl
SiCl4
B . 浓HCl 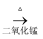 Cl2
Cl2  漂白粉
C . Fe
漂白粉
C . Fe  Fe2O3
Fe2O3  FeCl3
D . Mg(OH)2
FeCl3
D . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  无水MgCl2
无水MgCl2
下列说法正确的是( )
A . 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B . 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C . 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D . 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生 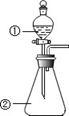

NA为阿伏加德罗常数的值.下列说法正确的是( )
A . 46g乙醇中存在的共价键总数为7NA
B . HNO3作为氧化剂得到的电子数一定为3NA
C . 1mol甲醇完全燃烧时,转移的电子数为6NA
D . 将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
化学与生活密切相关。下列说法错误的是 ( )
A . 铁水打花是一种古老的烟花,操作是“将生铁装进坩泥锅,并化成沸腾的铁汁”,其中坩泥锅的主要成分是硅酸盐
B . 液氨可用作制冷剂是由于液氨汽化吸热
C . 《梦溪笔谈》中“取精铁锻之百余火,…则纯钢也,虽百炼,不耗矣。”百炼钢熔点比纯铁高
D . 华为最新一代旗舰芯片麒麟9905G中半导体材料为硅
设NA表示阿伏加德罗常数,下列说法正确的是( )
A . 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA
B . 常温常压下,23 g NO2和N2O4的混合气体一定含有NA个氧原子
C . 标准状况下,22.4L酒精所含分子数为NA
D . 向某无色溶液中滴加BaCl2溶液,产生白色沉淀,原溶液中一定含有SO42-
按要求完成填空。
-
(1) 等物质的量的盐酸、苛性钠溶液分别与两份足量的铝粉反应,在相同条件下产生氢气的体积之比为
-
(2) 除去NaHCO3溶液中的Na2CO3杂质应,离子方程式为
-
(3) 将一小块金属钠投入到FeCl3溶液中,此时观察到的现象是 ,有关化学反应方程式是
同温、同压下,若A容器中充满O2 , B容器中充满O3。
-
(1) 若所含分子总数相等,则A容器和B容器的容积之比是。
-
(2) 若两容器中所含原子总数相等,则A容器和B容器的容积比是。
-
(3) 若两容器的体积比为3∶2,则O2和O3物质的量之比为,质量之比为,密度之比为。
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

请回答下列问题:
-
(1) A极是电源的,一段时间后,甲中溶液颜色,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明,在电场作用下向Y极移动。
-
(2) 若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的质量之比为。
-
(3) 现用丙装置给铜件镀银,则G应是(填“镀层金属”或“镀件”)。当乙中溶液的pH是13时(此时乙溶液体积为100mL),丙中镀件上析出银的质量为.
聚合氯化铝化学式为[Al2(OH)6Cl6-a]n是一种无机高分子铝的聚合物,己广泛用于生活废水处理。由偏铝酸钙[Ca(AlO2)2]制备聚合氯化铝的一种工艺流程如图:

-
(1) “沉淀1”的化学式是,“碱溶”后溶液的pH=12,“沉淀1”中不含Ca(OH)2则溶液中的c(CO
 )>mol•L-1。(Ksp(Ca(OH)2=6×10-6 , Ksp(CaCO3)=3×10-9)
)>mol•L-1。(Ksp(Ca(OH)2=6×10-6 , Ksp(CaCO3)=3×10-9)
-
(2) “沉降”时温度控制在40℃左右,主要原因是,“沉降”的离子方程式是。
-
(3) “洗涤”的目的是,实验室检验该洗涤已干净的操作是。
-
(4) 若要使聚合氧化[Al2(OH)aCl6-a]n中a=3,“酸化”时除控制温度外,理论上还需控制投料比n[Al(OH)3:n(HCl)=,为了达到上述目的,实际生产中可以采用控制的条件是。
将钠、铝混合物投入足量水(质量为100g)中进行反应,若钠、铝的质量分别为46g和27g,充分反应后,下列说法正确的是( )
A . 产生 的物质的量为2.5mol
B . 溶液中的溶质只有
的物质的量为2.5mol
B . 溶液中的溶质只有 C . 金属未完全溶解
D .
C . 金属未完全溶解
D .  的质量分数是
的质量分数是
 的物质的量为2.5mol
B . 溶液中的溶质只有
的物质的量为2.5mol
B . 溶液中的溶质只有 C . 金属未完全溶解
D .
C . 金属未完全溶解
D .  的质量分数是
的质量分数是
设 为阿伏加德罗常数的值,下列说法错误的是( )
为阿伏加德罗常数的值,下列说法错误的是( )
 为阿伏加德罗常数的值,下列说法错误的是( )
为阿伏加德罗常数的值,下列说法错误的是( )
A . 0.5mol  含有的质子数为5.5
含有的质子数为5.5 B . 2.24L
B . 2.24L  中含有的共用电子对数为0.4
中含有的共用电子对数为0.4 C . 1mol
C . 1mol  固体中共价键总数为4
固体中共价键总数为4 D . 2.0g
D . 2.0g  中含有的电子数和中子数均为
中含有的电子数和中子数均为
 含有的质子数为5.5
含有的质子数为5.5 B . 2.24L
B . 2.24L  中含有的共用电子对数为0.4
中含有的共用电子对数为0.4 C . 1mol
C . 1mol  固体中共价键总数为4
固体中共价键总数为4 D . 2.0g
D . 2.0g  中含有的电子数和中子数均为
中含有的电子数和中子数均为
最近更新



