第二节 金属材料 知识点题库
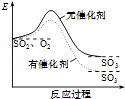 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B .
如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B .  如图表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化
C .
如图表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化
C . 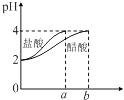 如图表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D .
如图表示分别稀释10 mL pH=2的盐酸和醋酸时溶液pH的变化,图中b>100
D . 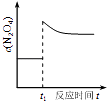 如图表示平衡2NO2(g)⇌N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
如图表示平衡2NO2(g)⇌N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
-
(1) 海水中蕴含的元素有80多种,它是一个巨大的宝藏.
①海水中镁的总储量约为1.8×1015 t,海水里镁的存在形式主要是.(填“游离态”或“化合态”)
②下列物质不经过化学变化就能从海水中获得的是.(填字母)
A.单质钠 B.单质钾 C.氯化钠
③目前化学工业的主要支柱之一是氯碱工业,它是以为基础制取氯气等产品的工业.
-
(2) 材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活.
①工业上制造光导纤维的基本原料是.
②下列物质中,不能用来制造耐火材料的是.(填字母)
A.氧化镁 B.过氧化钠 C.三氧化二铝
③在生铁和钢这2种金属材料中,含碳量较高的是.
-
(3) 保持洁净安全的生存环境已成为全人类的共识.
①pH<的雨水称为酸雨.燃煤产生的是引起我国酸雨的主要原因.
②下列物质中,会破坏臭氧层的是.(填字母)
A.氮气 B.一氧化碳 C.氟氯烃
③在生产中,人们曾用浓氨水来检验氯气管道是否漏气,已知能发生的反应为(在有水蒸气存在时):2NH3+3Cl2=6HCl+N2 , 则如果氯气管道某处漏气,用该方法检查时的现象是.
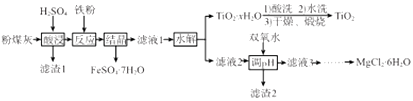
已知:①“酸浸”后钛主要以TiOSO4形式存在,强电解质TiOSO4在溶液中仅能电离SO42-和一种阳离子
②常温下,Ksp[Al(OH)3]=1.0×10-34 , Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Mg(OH)2]=1.0×10-11
请回答下列问题:
-
(1) “酸浸”时TiO2发生反应的离子方程式为。
-
(2) “反应”时加入铁粉的作用为。
-
(3) “结晶”需控制在70℃左右,温度过高会导致的后果为。
-
(4) “水解”反应的离子方程式为。所得TiO2•xH2O 沉淀进行酸洗的目的为。
-
(5) 为使滤渣2沉淀完全(溶液中离子浓度小于10-5mol/L)。需“调pH”最小为。
-
(6) 实验室用MgCl2溶液制备MgCl2•6H2O,需进行的操作为、降温结晶、过滤、洗涤、干燥。
-
(7) FeSO4•7H2O样品纯度的测定:取a g样品溶于水配成bmL.溶液;用酸化的cmol/LKMnO4标准溶液滴定,达到滴定终点时消耗标准液的体积为dmL,样品中FeSO4•7H2O的质量分数为 (用代数式表示)。
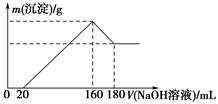
-
(1) 加入NaOH溶液0~20 mL时的反应的离子方程式为,160~180 mL时的反应的离子方程式为。
-
(2) 合金中Mg的质量为g,所用HCl的物质的量浓度为mol/L。
-
(1) MgCl2固体中含离子总数为1.806×1024个,将其配成2000mL溶液,求:
①c(MgCl2)=。
②c(Cl-)=。
-
(2) 配制500mL含Fe3+56g的Fe2(SO4)3溶液,需要6.25mol/L的Fe2(SO4)3溶液的体积为mL。
-
(3) mL 2 mol/L的NaOH溶液中所含溶质的质量和200mL 1 mol/L的Na2SO4溶液所含溶质的质量相等。
-
(4) 11.7克NaCl配制成100mL溶液,此溶液中c(Cl-)与标准状况下44.8升HCl配成V L溶液中的c(Cl-)相等,求V=。
-
(5) 含34.2g Al2(SO4)3的溶液,其体积与0.5mol/L含Na2SO4质量为142g的溶液体积相同。求该Al2(SO4)3溶液中c(SO42-)=。
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 B .
B . 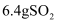 与
与 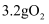 充分反应,转移的电子数为
充分反应,转移的电子数为  C .
C . 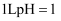 的稀硫酸中含有的氢离子数目为
的稀硫酸中含有的氢离子数目为  D . 4.6g有机物
D . 4.6g有机物  的分子结构中碳氢键数目一定为
的分子结构中碳氢键数目一定为 
| 选项 | 实验操作及现象 | 解释或结论 |
| A | 将氯水滴入碘化钾淀粉溶液中,溶液变成蓝色 | Cl2的氧化性强于I2 |
| B | 切开一小块金属钠,钠表面很快变暗 | 钠在空气中会生成Na2O2 |
| C | 向某钠盐溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该盐一定是Na2CO3 |
| D | 用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热,铝熔化但不滴落 | Al的熔点高于Al2O3 |
 mol
D . Wg该氯原子所含的电子个数为
mol
D . Wg该氯原子所含的电子个数为 
 含
含  、
、  ,过滤后得到的滤液用
,过滤后得到的滤液用  溶液,测得溶液pH、
溶液,测得溶液pH、 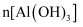 随加入
随加入  溶液体积变化的曲线如图所示。下列有关说法错误的是( )
溶液体积变化的曲线如图所示。下列有关说法错误的是( ) 
 溶液的物质的量浓度为
溶液的物质的量浓度为  B . 生成沉淀的离子方程式为
B . 生成沉淀的离子方程式为 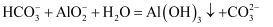 C . a点溶液中大量存在的离子是
C . a点溶液中大量存在的离子是  、
、  、
、 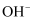 D . b点与c点溶液所含微粒种类相同
D . b点与c点溶液所含微粒种类相同

 )是一种良好的耐磨材料。实验室可用无水氯化铬(
)是一种良好的耐磨材料。实验室可用无水氯化铬(  )与氨气在高温下反应制备,反应原理为:
)与氨气在高温下反应制备,反应原理为:  。
。 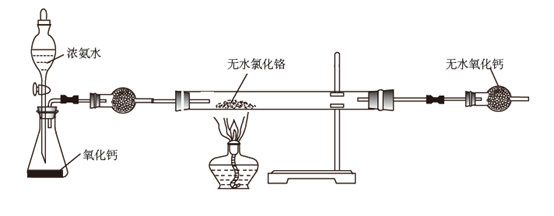
下列说法正确的是( )
 )脱水得到
B . 反应开始时应先将硬质玻璃管预热,再打开分液漏斗活塞
C . 硬质玻璃管右端的导气管过细,易产生堵塞
D . 将12.8g产品在空气中充分加热,得15.2g固体残渣(
)脱水得到
B . 反应开始时应先将硬质玻璃管预热,再打开分液漏斗活塞
C . 硬质玻璃管右端的导气管过细,易产生堵塞
D . 将12.8g产品在空气中充分加热,得15.2g固体残渣(  ),产品中可能含有
),产品中可能含有 
-
(1) Na2O2与水反应的化学方程式。
-
(2) Na2O2的物质的量。
-
(3) 若最终形成500mL溶液,反应后溶液中溶质的物质的量浓度。



