第三节 化学键 知识点题库
(1)其中只含有离子键的化合物是 ;
(2)其中仅含有极性共价键的原子晶体是 ;
(3)其中含有极性共价键的离子化合物是 ;
(4)其中含有非极性共价键的共价化合物是 ;
(5)其中含有范德华力又只含有极性共价键的分子晶体是
①CaBr2②H2O ③NH4Cl ④H2O2⑤Na2O2⑥Ca(OH)2⑦HClO ⑧I2⑨He
-
(1) 含有共价键的离子化合物是(用序号回答),含有共价键的共价化合物是(用序号回答).
-
(2) 当其熔化时,不破坏化学键的是(用序号回答).
-
(3) 写出下列物质或微粒的电子式:H2O;Na2O;CO2
-
(1) 在H2O、NaCl、NaOH、Na2O2、H2O2中,既含有非极性键又含有极性键的是,既含有离子键又含有极性键的是;
-
(2) 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
工业生产甲醇的常用方法是:CO(g)+2H2 (g)⇌CH3OH(g)△H=﹣91.0kJ/mol ①
已知:2H2 (g)+O2 (g)═2H2O (l)△H=﹣572.0kJ/mol ②
H2 (g)+
 O2 (g)═H2O(g)△H=﹣263.0kJ/mol ③
O2 (g)═H2O(g)△H=﹣263.0kJ/mol ③①H2的燃烧热为 kJ/mol.
②CH3OH(g)+O2 (g)⇌CO(g)+2H2O(g)的反应热△H=kJ/mol.
①离子化合物一定含离子键,也可能含共价键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥离子化合物在熔融状态下能导电.
-
(1) 在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl
②Cl+H2→HCl+H
③H+Cl2→HCl+Cl
…
反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性”).
-
(2) 已知在短周期主族元素中,元素a与氯元素相邻且属同一周期,元素b也与氯元素相邻且属于同一主族,那么比较元素a、b以及氯元素三者的原子半径由大到小的顺序是(用元素符号表示).与氯元素同周期且金属性最强的元素位于周期表的第周期族.
-
(3) 卤素单质及化合物在许多性质上都存在着递变规律.下列有关说法错误的是 (填字母).A . 卤素单质的熔沸点按F2、Cl、Br2、I2的顺序由低到高 B . 原子半径按 C . Cl、Br、I的顺序由大到小 D . 卤化氢的稳定性按的H E . HCl、HBr、HI的顺序由强到弱 F . 卤素单质与氢气化合按的F2、Cl2、Br2、I2顺序由难变易
-
(4) 碘单质及其化合物具有重要应用.下列说法正确的是(填字母).
a.
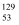 I与
I与 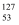 I互为同位素
I互为同位素b.加碘食盐能使淀粉溶液变蓝
c.从海带中提取I2的过程只发生化学变化
d.提纯含泥沙的粗碘可用升华法.
-
(1) 属于金属晶体的是,属于离子晶体的是,属于分子晶体的是,属于原子晶体的是.
-
(2) 熔化时不需要破坏化学键的是,熔化时需要破坏共价键的是,熔点最高的是,熔点最低的是.
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2 、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2·8H2O与NH4Cl的反应均既为氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物
-
(1) X在元素周期表中的位置为,X单质的结构式为。
-
(2) W的简单气态氢化物电子式是,该气态氢化物溶于水时,破坏的化学键是。
-
(3) Y、Z、W的原子半径从大到小的顺序是(用元素符号表示)。Y的最高价氧化物的水化物和Z的最高价氧化物的水化物反应的离子方程式是。
-
(1) Ⅰ.现有A、B、C、D、E、F、G七种短周期主族元素,其原子序数依次增大。已知A、D位于同一主族,D是短周期中原子半径最大的。B、E最外层电子数是最内层电子数的2倍。C、F的最外层电子数相等,且C、F的原子序数之和为A、D原子序数之和的两倍。请回答下列问题:
A、C、D、F形成的简单离子半径由大到小的顺序是(用元素符号填写)。
-
(2) B、C、E、F、G形成的气态氢化物数目最多的元素是(填元素符号),所形成的简单气态氢化物中最不稳定的是(填化学式)。
-
(3) B、E、F、G最高氧化物对应的水化物酸性由强到弱的顺序是(用化学式填写)。
-
(4) 由A、C、D形成的化合物所含的化学键类型有。
-
(5) 用电子式表示F的氢化物的形成过程。
-
(6) 化合物M和N都由A、C、D、F四种元素组成,它们在溶液中相互反应的离子方程式是;G单质的水溶液中通入F的氧化物,其反应的化学方程式为。
-
(7) Ⅱ.中学化学中几种常见物质的转化关系如图:

将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
红褐色胶体中F粒子直径大小的范围:。
-
(8) 写出B的化学式:B。
-
(9) ①H2O2分子的电子式:。
②写出C的酸性溶液与双氧水反应的离子方程式:。
-
(10) 写出鉴定E中阳离子的实验方法和现象:。
-
(11) 在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式:。
-
(1) LiCoO2、LiFePO4常用作锂离子电池的正极材料。基态磷原子中,电子占据的最高能层符号为。
-
(2) 锂离子电池的电解液有LiBF4等,碳酸亚乙酯(
 )用作该电解液的添加剂。LiBF4中阴离子的空间构型为。
)用作该电解液的添加剂。LiBF4中阴离子的空间构型为。
-
(3) 已知Fe2+的半径为61 pm,Co2+的半径为65 pm,由此推断在隔绝空气条件下分别加热FeCO3、CoCO3 , 其中的分解温度低。
-
(4) 形成化学键的π电子不局限于两个原子的区域,而是在参加成键的多个原子的分子骨架中运动,这种由多个原子形成的π型化学键称作离域π键。一般地,其形成需要满足下列条件:①原子共面,每个原子提供一个方向相同的p轨道,或合适的d轨道;②π电子数小于参加成键的轨道数的二倍。芳香化合物及许多其他体系存在离域π键。离域π键可用
 表示,n为参与形成离域π键原子数,m为参与形成离域π键电子数,例如苯为
表示,n为参与形成离域π键原子数,m为参与形成离域π键电子数,例如苯为  , 已知萘
, 已知萘  中存在1个离域π键,可表示为。
中存在1个离域π键,可表示为。
-
(5) Li2S是目前研发的锂离子电池的新型固体电解质,为立方晶系晶体,晶胞参数为d nm,晶胞截面图如图所示。





每个晶胞中含有的S2¯ 数目为;Li+填充在S2¯ 构成的空隙中,每一个空隙由个S2¯构成,空隙的空间形状为。
-
(1)
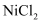 呈黄色,其中
呈黄色,其中 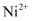 的价电子轨道表示式为。
的价电子轨道表示式为。
-
(2)
 呈绿色,晶体结构与氯化钠类似,每个
呈绿色,晶体结构与氯化钠类似,每个 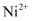 周围有个最近距离的
周围有个最近距离的  。
。
-
(3)
 是一种无色挥发性液体,沸点为
是一种无色挥发性液体,沸点为  ,熔点为
,熔点为  。
。 ①它形成的晶体类型为。
②配体
 中
中 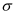 键和
键和  键的个数比为。
键的个数比为。 -
(4) 丁二酮肟镍呈鲜红色,其结构如下图。

①分子中第二周期元素的第一电离能由大到小的顺序为。
②丁二酮肟镍分子中存在的化学键有。
A.共价键 B.氢键 C.离子键 D.金属键 E.配位键
 B .
B .  C .
C .  D .
D . 

 B . 步骤②有机物发生了还原反应
C . 步骤④有极性键的断裂与形成
D . 铜基催化剂的使用可以提高二氧化碳合成甲醇的平衡转化率
B . 步骤②有机物发生了还原反应
C . 步骤④有极性键的断裂与形成
D . 铜基催化剂的使用可以提高二氧化碳合成甲醇的平衡转化率

-
(1) 基态铬原子价电子排布式为,未成对电子数为。
-
(2) 铬的一种含氧酸——铬酸(H2CrO4),结构和硫酸类似。其阴离子CrO
 的立体构型为,铬酸是一种二元强酸,原因是。
的立体构型为,铬酸是一种二元强酸,原因是。
-
(3) 含铬的化合物吡啶甲酸铭是一种用于二型糖尿病的保健药,其结构如图所示。

①该化合物中H、C、N、O的电负性由大到小的顺序为,N原子的杂化轨道类型为。
②该化合物中含有的化学键类型有(填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键 e.氢键
-
(4) 铬的某种氧化物晶胞如图所示(灰球代表铬原子,黑球代表氧原子)。

该氧化物的化学式为,铬原子的配位数是;该晶体的密度为g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即)。
 中加入足量浓硫酸,发生反应:
中加入足量浓硫酸,发生反应:  。下列说法错误的是( )
。下列说法错误的是( )
 中的两种酸根阴离子分别为
中的两种酸根阴离子分别为  和
和 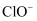 B .
B .  中不含非极性共价键
C . 在上述反应中,浓硫酸不体现氧化性
D . 每产生0.1mol
中不含非极性共价键
C . 在上述反应中,浓硫酸不体现氧化性
D . 每产生0.1mol  ,转移电子的数目约为
,转移电子的数目约为 



