第三节 化学键 知识点题库
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6 , 它的熔点为150℃,燃烧时放出大量的热量。Al2H6球棍模型如下图。下列说法肯定错误的是( )
A . Al2H6在固态时所形成的晶体是分子晶体
B . 氢铝化合物可能成为未来的储氢材料和火箭燃料
C . Al2H6在空气中完全燃烧,产物为氧化铝和水
D . Al2H6中含有离子键和极性共价键
下列物质中既有有离子键又有共价键的是( )
A . Na2S
B . NaCl
C . Na2O2
D . BaCl2
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3 . 它的酸性类似于醋酸,可微弱电离出H+和N3﹣ .
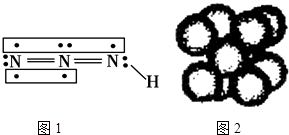
试回答下列问题:
-
(1) 下列说法正确的是 (选填序号).A . 酸性:HNO2>HNO3 B . N2H4中两个氮原子采用的都是sp2杂化 C . HN3、H2O都是极性分子 D . N2H4沸点高达113.5℃,说明肼分子间可形成氢键
-
(2) 叠氮化物能与Fe3+、Cu2+及Co3+等形成配合物,如:[Co(N3)(NH3)5]SO4 , 在该配合物中钴显价,根据价层电子对互斥理论可知SO42﹣的立体构型为,写出钴原子在基态时的核外电子排布式:.
-
(3) 由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)═2Na(l)+3N2(g),下列说法正确的是 (选填序号).A . NaN3与KN3结构类似,前者晶格能较小 B . 钠晶胞结构如图2,晶胞中分摊2个钠原子 C . 氮的第一电离能大于氧 D . 氮气常温下很稳定,是因为氮元素的电负性小
-
(4) 与N3﹣互为等电子体的分子有:(举两例).
下列物质中含有共价键的离子化合物是( )
A . H2
B . NaCl
C . NaOH
D . H2S
下列哪一组元素的原子间反应容易形成离子键( )
原子 | a | b | c | d | e | f | g |
M层电子数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
A . a和c
B . a和f
C . d和g
D . e和g
下列说法正确的是( )
A . 500 mL 1mol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2SO4溶液所含硫酸根离子的浓度相等
B . 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q
C . 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03NA
D . 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L
下列物质中既含有离子键又含有共价键的是( )
A . HCl
B . KOH
C . I2
D . Na2 O
下列各组物质中,化学键类型不同的是( )
A . NaCl和K2O
B . H2O和NH3
C . CaF2和NaCl
D . CCl4和Na2 SO3
某些化学键的键能数据如下表所示:
键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 436 | 193 | 151 | 247 | 431 | 299 | 356 |
分析上表中的数据,下列结论正确的是( )
A . 1 mol Cl2分解为气态原子时,需要放出247 kJ的能量
B . 由表中所列化学键形成的单质分子中,最稳定的是H2,形成的化合物分子中,最不稳定的是HI
C . 在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是I2>Br2>Cl2
D . 预测1 mol H2在足量F2中燃烧比在Cl2中燃烧放热少
下列物质中,既含共价键又含离子键的是( )
A . NaCl
B . O2
C . NH4Cl
D . CO2
下列说法正确的是( )
A . 离子键就是使阴、阳离子通过共用电子对而形成的
B . 氯化钠的分子式为 NaCl
C . 离子化合物受热熔化时可以导电
D . 离子化合物溶解时,离子键不受破坏
向H2O2溶液中加入Br2可以加快H2O2分解速率。其反应机理可能有两步,第1步:H2O2+Br2→2H++O2↑+2Br-。下列说法正确的是( )
A . H2O2分子中含有离子键和非极性键
B . 第1步反应每生成0.1 mol O2 , 转移0.4 mol电子
C . 第2步反应为:2H++H2O2+2Br-→2H2O +Br2
D . H2O2分解反应前后溶液中Br2的质量不变
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高价氧化物固态时可用作人工降雨剂或用于冷藏食品,X、Y的最外层电子数之和与W的最外层电子数相等,W的简单氢化物与Z的单质混合光照可生成Z的氢化物和油状混合物。下列说法正确的是( )
A . 原子半径:W>X>Y>Z
B . X、Y的简单离子的电子层结构相同
C . W的简单氢化物的稳定性比Z的强
D . Z分别与W、X形成的化合物中所含化学键类型相同
几种短周期元素的主要化合价及原子的原子半径数据见下表:
| 元素代号 | L | M | Q | R | T |
| 主要化合价 | +2 | +3 | +6、﹣2 | +7、﹣1 | ﹣2 |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
据表中信息判断,下列有关叙述中,正确的是( )
A . L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B . M和R形成的化合物中含有离子键
C . Q、T两元素形成的二元化合物不止一种
D . L与R两元素形成的化合物中,含有非极性共价键
下列说法正确的是( )
A . 离子化合物中只含有离子键
B . 化学键只存在于分子之间
C . 氯化氢溶于水时破坏了共价键
D . 由非金属元素组成的化合物都是共价化合物
 晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为0.446nm,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。下列叙述错误的是( )
晶体是一种性能良好的光学材料,其晶胞为立方体,棱长为0.446nm,晶胞中K、I、O分别处于顶点、体心、面心位置,如图所示。下列叙述错误的是( ) 
A . 基态K原子的核外电子排布式为:  B . 碘酸钾中含有离子键和共价键
C . 与O原子紧邻的I原子有2个
D .
B . 碘酸钾中含有离子键和共价键
C . 与O原子紧邻的I原子有2个
D .  晶体中K原子与O原子间的最短距离约为0.631nm
晶体中K原子与O原子间的最短距离约为0.631nm
 B . 碘酸钾中含有离子键和共价键
C . 与O原子紧邻的I原子有2个
D .
B . 碘酸钾中含有离子键和共价键
C . 与O原子紧邻的I原子有2个
D .  晶体中K原子与O原子间的最短距离约为0.631nm
晶体中K原子与O原子间的最短距离约为0.631nm
CO甲烷化反应为:  。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢 。
。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢 。
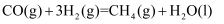 。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢 。
。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢 。 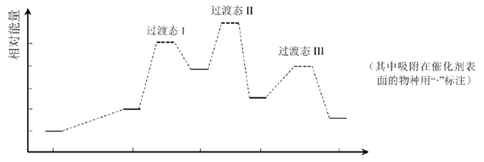
CO(g)+H2(g) 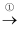 CO(g)+·H
CO(g)+·H  ·CHO
·CHO  ·CH+H2O(l)→CH4(g)
·CH+H2O(l)→CH4(g)
下列说法错误的是( )
A . 步骤①只有非极性键断裂
B . 步骤②速率最慢的原因可能是其活化能最高
C . 步骤③需要吸收热量
D . 使用该催化剂不能有效提高CO平衡转化率
下列说法中错误的是( )
A . 非金属元素间不可能形成离子键
B . 两个非金属原子之间形成的化学键一定是共价键
C . 含有离子键的物质不可能是单质
D . 单质中不一定含有共价键
下列对化学用语的描述中,正确的是( )
A . 羟基、氢氧根离子的电子式都可表示为: B .
B . 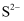 的结构示意图:
的结构示意图: C . 由
C . 由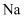 与
与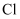 形成
形成 的过程:
的过程:

 D .
D .  的结构式:
的结构式: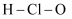
 B .
B . 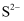 的结构示意图:
的结构示意图: C . 由
C . 由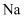 与
与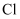 形成
形成 的过程:
的过程:

 D .
D .  的结构式:
的结构式: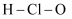
目前,科学家发现在负压和超低温条件下,可将水形成像棉花糖一样的气溶胶的冰,该冰称为“气态冰”。下列说法不正确的是( )
A . 该冰具有丁达尔效应
B . 该条件下18 g“气态冰”的体积等于22.4 L
C . “气态冰”分子中存在极性共价键
D . “气态冰”与普通冰化学性质相同
最近更新



