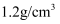第一单元 氯气及氯的化合物 知识点题库
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为(2KMnO4 K2MnO4+MnO2+O2↑,2KClO3
K2MnO4+MnO2+O2↑,2KClO3 2KCl+3O2↑,2H2O2
2KCl+3O2↑,2H2O2 O2↑+2H2O)( )
O2↑+2H2O)( )
A . 1:1:1
B . 2:2:1
C . 2:3:1
D . 4:3:2
下列氧化还原反应中电子转移情况分析正确的是( )
A . 
B .
B . 
C .
C . 
D .
D . 

B .
B . 
C .
C . 
D .
D . 
已知在酸性条件下,下列物质氧化KI时,自身发生如下变化:Cl2→2Cl﹣;MnO4﹣→Mn2+; Cr2O72﹣→Cr3+;HNO3→NO如果分别用等物质的量的这些物质氧化足量的KI,得到I2的量最多的是( )
A . Cl2
B . MnO4﹣
C . Cr2O72﹣
D . HNO3
PbO2具有强氧化性,自身受热分解释放出O2并生成+2价的氧化物(PbO),+4价的Pb还能氧化浓盐酸生成Cl2。现将1 mol PbO2加热分解得到一定量的O2 , 再向剩余固体中加入足量的浓盐酸得到Cl2 , 且O2和Cl2的物质的量之比为3 :2,请计算:
-
(1) 剩余固体的成分及物质的量之比。
-
(2) O2和Cl2的物质的量之和为。
科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N2H44+两种离子形式存在,植物的根系极易吸收N2H44+ , 但它遇到碱时,会生成一种形似白磷的N4分子。N4分子不能被植物吸收。下列有关说法错误的是( )
A . N4和N2互为同素异形体
B . 14N与14C互为同位素
C . N4H4(SO4)2不能与草木灰混合使用
D . 8NH3+4C5OH=N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子
硫代硫酸钠可作为脱氯剂,已知25.0mL0.100mol/LNa2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32—将转化成( )
A . S2-
B . S
C . SO32-
D . SO42-
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:

-
(1) 连接上述仪器的正确顺序是:E接,接,接H,G接F。
-
(2) 气体发生装置中进行的反应化学方程式是 ;当足量的MnO2与2mol浓盐酸充分反应后(不考虑浓盐酸的挥发),得到的氯气的物质的量小于0.5mol的原因是。
-
(3) 在装置中:①饱和食盐水的作用是,②浓硫酸的作用是。
-
(4) 化学实验中检验是否有Cl2产生常用,如果有Cl2产生,可观察到的现象是,写出反应方程式。
向含有FeBr2溶液中通入一定量的Cl2(还原性:Fe2+>Br-),表示该反应的离子方程式肯定错误的是( )
A . 2Fe2++Cl2=2Fe3++2Cl-
B . 10Fe2++2Br-+6Cl2=10Fe3++Br2+12Cl-
C . 2Br-+Cl2=Br2+2Cl-
D . 2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
-
(1) CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是。
-
(2) 草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。

①通过计算确定A点剩余固体的化学成分为(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为。
我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述错误的是( )
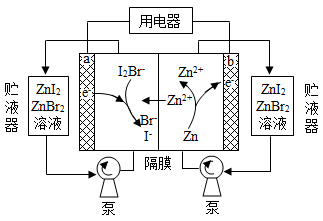
A . 放电时,a电极反应为  B . 放电时,溶液中离子的数目增大
C . 充电时,b电极每增重
B . 放电时,溶液中离子的数目增大
C . 充电时,b电极每增重 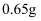 ,溶液中有
,溶液中有  被氧化
D . 充电时,a电极接外电源负极
被氧化
D . 充电时,a电极接外电源负极
 B . 放电时,溶液中离子的数目增大
C . 充电时,b电极每增重
B . 放电时,溶液中离子的数目增大
C . 充电时,b电极每增重 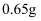 ,溶液中有
,溶液中有  被氧化
D . 充电时,a电极接外电源负极
被氧化
D . 充电时,a电极接外电源负极
实验室制  的反应为
的反应为  ,下列说法错误的是( )
,下列说法错误的是( )
 的反应为
的反应为  ,下列说法错误的是( )
,下列说法错误的是( )
A . 还原剂是  ,氧化剂是
,氧化剂是  B . 每消耗1mol
B . 每消耗1mol  ,起还原作用的
,起还原作用的  消耗4mol
C . 每生成1mol
消耗4mol
C . 每生成1mol  ,转移电子的物质的量为2mol
D . 生成的
,转移电子的物质的量为2mol
D . 生成的  中,除含有一些水蒸气外,还含有杂质
中,除含有一些水蒸气外,还含有杂质 
 ,氧化剂是
,氧化剂是  B . 每消耗1mol
B . 每消耗1mol  ,起还原作用的
,起还原作用的  消耗4mol
C . 每生成1mol
消耗4mol
C . 每生成1mol  ,转移电子的物质的量为2mol
D . 生成的
,转移电子的物质的量为2mol
D . 生成的  中,除含有一些水蒸气外,还含有杂质
中,除含有一些水蒸气外,还含有杂质 
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A . 0.1 mol Fe在0.1 mol氯气中充分燃烧时转移的电子数为0.3NA
B . 0.1 mol乙烷和丙烯的混合物所含氢原子数目为0.6NA
C . 64 g的SO2与足量的O2充分反应后可得到NA个SO3分子
D . 标准状况下,2.24 L四氯化碳含有的分子数目为0.1NA
某学习小组为探究传统的Al—空气—海水电池,设计了如图所示的实验装置。该电池工作时,下列说法正确的是( )
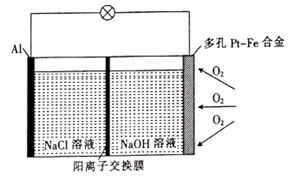
A . 多孔Pt—Fe合金电极有利于吸附O2
B . 负极的电极反应式为  C . 若反应中消耗5.4 g Al,则消耗3.36 L O2
D . 当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
C . 若反应中消耗5.4 g Al,则消耗3.36 L O2
D . 当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
 C . 若反应中消耗5.4 g Al,则消耗3.36 L O2
D . 当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
C . 若反应中消耗5.4 g Al,则消耗3.36 L O2
D . 当1 mol O2参与反应时,有4 mol阳离子通过阳离子交换膜
某实验小组为制取纯净干燥的Cl2并检验Cl2的性质,设计了如图装置。 

资料表明装置D中硬质玻璃管内产物有以下性质:①受热易升华,冷却后易凝华;②遇水蒸气剧烈反应。
回答下列问题:
-
(1) 装置A中反应的离子方程式为。
-
(2) 实验开始前,先连接装置,检查装置的气密性,写出检查装置气密性的操作方法:。
-
(3) 实验中有两处酒精灯需要点燃,则应先点燃装置 (填“A”或“D”)中的酒精灯,目的是。
-
(4) 装置C中浓硫酸的作用是。
-
(5) 装置D中反应现象为,写出该反应的化学方程式。
-
(6) 装置F中烧杯内盛放的溶液的溶质为(填化学名称),作用是。
下列关于氯及其化合物的说法错误的是( )
A . 氢气能在氯气中安静燃烧,发出苍白色火焰,并生成白烟
B . 铁在氯气中点燃时剧烈反应,但液氯可储存在钢瓶中
C . 氯气具有强氧化性,能使湿润的淀粉-KI试纸变蓝
D . 漂白粉溶液中加入稀硫酸,其漂白作用增强
在如图所示的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体。挤压滴管的胶头,下列与实验事实不相符的是( )
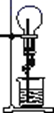
| 选项 | 气体 | 液体 | 喷泉颜色 |
| A | Cl2 | 饱和食盐水 | 黄绿色喷泉 |
| B | NH3 | 含有酚酞的H2O | 红色喷泉 |
| C | HCl | AgNO3溶液 | 白色喷泉 |
| D | CO2 | 含有酚酞的NaOH溶液 | 红色喷泉 |
A . A
B . B
C . C
D . D
“新冠”疫情期间,人们广泛使用“84”消液(有效成分 )回答下列问题:
)回答下列问题:
 )回答下列问题:
)回答下列问题:84消毒液 (有效成分) (规格) (质量分数)25% (密度) |
-
(1) 用氯气制备“84”消毒液的离子方程式为,如图是某“84”消毒液的标签,
 的物质的量浓度为
的物质的量浓度为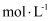 (保留1位小数)。使用时通常稀释100倍(体积比),稀释时需要使用的玻璃仪器为胶头滴管、玻璃棒、。
(保留1位小数)。使用时通常稀释100倍(体积比),稀释时需要使用的玻璃仪器为胶头滴管、玻璃棒、。
-
(2) 资料显示“84”消毒液不能与洁厕灵(含
 )混合使用,对此某小组开展如图所示的研究。
)混合使用,对此某小组开展如图所示的研究。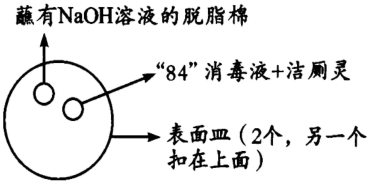
①两表面皿之间充满黄绿色气体。则“84”消毒液与洁厕灵反应的化学方程式为;
 的作用是。
的作用是。②生活中“84”消毒液不能与洁厕灵混合使用的原因是。
-
(3) “84”消毒液消毒衣服时要先用温水稀释后再浸泡一段时间,但温度不能高于50℃。则温度不宜过高的原因是。
四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4℃。某实验小组设计如图装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法错误的是( )

A . ②中应盛装饱和食盐水
B . 冷凝管有冷凝、回流和导气的作用
C . 反应结束时,应先停止③处的加热,后停止①处的加热
D . 该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
氯气可用作自来水厂的消毒剂,但使用过程中要注意防泄漏。下图为自来水厂一种预防和处理 泄漏的方法。下列有关说法不正确的是( )
泄漏的方法。下列有关说法不正确的是( )
 泄漏的方法。下列有关说法不正确的是( )
泄漏的方法。下列有关说法不正确的是( )
A . 实验室用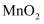 和盐酸反应制取氯气的离子方程式为:
和盐酸反应制取氯气的离子方程式为: B . 吸收漏氯的离子方程式为:
B . 吸收漏氯的离子方程式为: C . 铁屑耗尽时溶液可能大量存在:
C . 铁屑耗尽时溶液可能大量存在: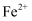 、
、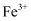 、
、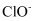 、
、 D . 铁屑的作用是将
D . 铁屑的作用是将 还原为
还原为
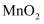 和盐酸反应制取氯气的离子方程式为:
和盐酸反应制取氯气的离子方程式为: B . 吸收漏氯的离子方程式为:
B . 吸收漏氯的离子方程式为: C . 铁屑耗尽时溶液可能大量存在:
C . 铁屑耗尽时溶液可能大量存在: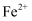 、
、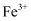 、
、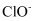 、
、 D . 铁屑的作用是将
D . 铁屑的作用是将 还原为
还原为
结晶水合物X由4种元素组成。某兴趣小组按如下流程进行实验:

请回答:
-
(1) 组成X的元素除H、O外还有 ,X的化学式为 。
-
(2) 溶液D中属于盐的成分是 ( 用化学式表示);若溶液C中滴入少量氨水,则首先参与反应的微粒是
-
(3) 请写出E →F化学方程式。
-
(4) 设计实验方案确定溶液H中的阴离子。
最近更新