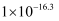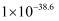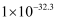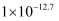第二单元 金属钠及钠的化合物 知识点题库
不能用离子方程式 CO32﹣+2H+=CO2↑+H2O表示的反应是( )
A . Na2CO3+2HCl=2NaCl+CO2↑+H2O
B . K2CO3+2HNO3=2KNO3+CO2↑+H2O
C . K2CO3+H2SO4=K2SO4+CO2↑+H2O
D . CaCO3+2HCl=CaCl2+CO2↑+H2O
为了测定已部分变质的过氧化钠样品的纯度,设计如图所示的实验装置,图中Q为弹性良好的气球(不与药品反应),称取一定量的样品放入其中.按如图所示的装置安装好仪器,打开分液漏斗的活塞,将稀硫酸滴入气球中.
请回答下列问题:

-
(1) Q内发生反应生成种气体,其中的反应有个为氧化还原反应.
-
(2) 为测定反应时生成气体的总体积,滴稀H2SO4前必须关闭(填“K1”、“K2”或“K3”),打开(填“K1”、“K2”或“K3”).
-
(3) 当上述反应停止时,将K1、K2、K3均关闭,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是.
-
(4) b中装的固体试剂是,需缓缓打开K1的原因为.
-
(5) 实验结束时,量筒Ⅰ 中有x mL水,量筒Ⅱ 中收集到y mL气体,则过氧化钠的纯度是(用含x、y的式子表示,上述体积均已折算成标准状况).
下列离子方程式正确的是( )
A . 硫酸氢铵溶液中滴加少量NaOH溶液:H++OH-=H2O
B . 过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
C . 漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+CO32-
D . 用氨水溶解氯化银沉淀:Ag++2 NH3·H2O=[Ag(NH3)2]++2H2O
分类法是学习和研究化学的一种常用的科学方法,下列分类合理的是( )
A . 根据分散系的稳定性将其分为胶体、溶液和浊液
B . 根据化合物在溶液中能否电离将其分为强电解质和弱电解质
C . 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸和多元酸
D . 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
下列离子方程式中,只能表示一个化学反应的是( )
①CO32-+2H+=CO2↑+H2O
②Ba2++2OH-+2H++SO=BaSO4↓+2H2O
③Ag++Cl-=AgCl↓
④Fe+Cu2+=Fe2++Cu
⑤Cl2+H2O=H++Cl-+HClO
A . ①③
B . ②④
C . ②⑤
D . 只有⑤
1920年参与建设亚洲第一座纯碱厂——永利制碱厂,为我国纯碱工业发展做出杰出贡献的化学家是( )
A . 屠呦呦
B . 侯德榜
C . 张青莲
D . 徐光宪
下列离子方程式书写正确的是 ( )
A . 已知电离平衡常数:H2CO3>HClO>HCO,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO32-
B . 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-=3Br2+2NO↑+4H2O
C . 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D . 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O
下列各组关于强电解质、弱电解质、非电解质的分类完全正确的是( )
A | B | C | D | |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
非电解质 | 蔗糖 | BaSO4 | CO2 | Cl2 |
A . A
B . B
C . C
D . D
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化 合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | — |
| 最低负价 | — | -1 | — | — | -3 | -2 | |
下列说法正确的是 ( )
A . 元素X和Q形成的化合物呈淡黄色
B . X、Z、R的最高价氧化物的水化物之间可两两相互反应
C . Q2-比R3-更容易失去电子
D . M(OH)2的碱性比XOH的碱性强
下列反应的离子方程式书写错误的是( )
A . 钠与水反应:Na+H2O=Na++OH-+H2↑
B . 氯化钡溶液与稀硫酸反应:Ba2++SO  =BaSO4↓
C . 碳酸钠溶液与足量盐酸反应:CO
=BaSO4↓
C . 碳酸钠溶液与足量盐酸反应:CO  +2H+=CO2↑+H2O
D . 铜与稀硝酸反应:3Cu+8H++2NO
+2H+=CO2↑+H2O
D . 铜与稀硝酸反应:3Cu+8H++2NO  =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
 =BaSO4↓
C . 碳酸钠溶液与足量盐酸反应:CO
=BaSO4↓
C . 碳酸钠溶液与足量盐酸反应:CO  +2H+=CO2↑+H2O
D . 铜与稀硝酸反应:3Cu+8H++2NO
+2H+=CO2↑+H2O
D . 铜与稀硝酸反应:3Cu+8H++2NO  =3Cu2++2NO↑+4H2O
=3Cu2++2NO↑+4H2O
下列离子方程式书写正确的是( )
A . 向FeI2溶液通入少量氯气:2Fe2++ Cl2=2Fe3++ 2Cl-
B . CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++ H2O+CO2↑
C . NaHCO3溶液中加入少量的澄清石灰水:  + Ca2++OH-= CaCO3↓+ H2O
D . 向NH4Al(SO4)2溶液中加入氢氧化钡溶液,使
+ Ca2++OH-= CaCO3↓+ H2O
D . 向NH4Al(SO4)2溶液中加入氢氧化钡溶液,使  恰好沉淀完全:
恰好沉淀完全:  + Al3++2
+ Al3++2  +4OH- +2Ba2+=2BaSO4↓+ Al(OH)3↓+ NH3·H2O
+4OH- +2Ba2+=2BaSO4↓+ Al(OH)3↓+ NH3·H2O
 + Ca2++OH-= CaCO3↓+ H2O
D . 向NH4Al(SO4)2溶液中加入氢氧化钡溶液,使
+ Ca2++OH-= CaCO3↓+ H2O
D . 向NH4Al(SO4)2溶液中加入氢氧化钡溶液,使  恰好沉淀完全:
恰好沉淀完全:  + Al3++2
+ Al3++2  +4OH- +2Ba2+=2BaSO4↓+ Al(OH)3↓+ NH3·H2O
+4OH- +2Ba2+=2BaSO4↓+ Al(OH)3↓+ NH3·H2O
标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1NaOH溶液中,充分反应后溶液中c(CO32-)与c(HCO3-)的比值为(不考虑CO32-、HCO3-的水解) ( )
A . 1∶1
B . 1∶2
C . 2∶1
D . 1∶3
下列实验与对应示意图的关系正确的是( )
A . 向 NaAlO2 溶液中逐滴 滴加盐酸至过量 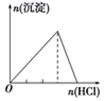 B . 向 AlCl3 溶液中逐滴 滴加氨水至过量
B . 向 AlCl3 溶液中逐滴 滴加氨水至过量 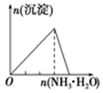 C . 向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量
C . 向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量 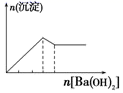 D . 向澄清石灰水中缓缓 通入 CO2 至过量
D . 向澄清石灰水中缓缓 通入 CO2 至过量 
 B . 向 AlCl3 溶液中逐滴 滴加氨水至过量
B . 向 AlCl3 溶液中逐滴 滴加氨水至过量  C . 向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量
C . 向明矾溶液中逐滴滴加Ba(OH)2 溶液至过量  D . 向澄清石灰水中缓缓 通入 CO2 至过量
D . 向澄清石灰水中缓缓 通入 CO2 至过量 
在给定条件下,下列选项中所示的物质间转化均能实现的是( )
A . SiO2  H2SiO3
H2SiO3  Na2SiO3
B . S
Na2SiO3
B . S  SO2
SO2 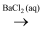 BaSO3
C . CuSO4
BaSO3
C . CuSO4  Cu(OH)2
Cu(OH)2 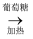 Cu2O
D . 饱和NaCl溶液
Cu2O
D . 饱和NaCl溶液  NaHCO3
NaHCO3  Na2CO3
Na2CO3
 H2SiO3
H2SiO3  Na2SiO3
B . S
Na2SiO3
B . S  SO2
SO2 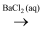 BaSO3
C . CuSO4
BaSO3
C . CuSO4  Cu(OH)2
Cu(OH)2 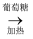 Cu2O
D . 饱和NaCl溶液
Cu2O
D . 饱和NaCl溶液  NaHCO3
NaHCO3  Na2CO3
Na2CO3
用软锰矿(主要成分为MnO2 , 含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下:
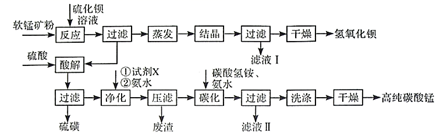
已知:MnO2是一种两性氧化物;25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | | | | |
回答下列问题
-
(1) 软锰矿预先粉碎的目的是,MnO2与BaS溶液反应转化为MnO的化学方程式为。
-
(2) 碳化过程中发生反应的离子方程式为。
-
(3) 滤液I可循环使用,应当将其导入到操作中(填操作单元的名称)。
-
(4) 净化时需先加入的试剂X为(填化学式),再加入氨水的目的是 。
-
(5) 检验碳酸锰沉淀是否洗涤干净的操作为 。
化学反应伴随着能量变化是化学反应的基本特征之一。某同学进行如下实验,以检验化学反应中的能量变化。
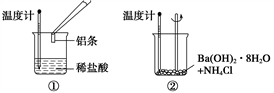
请回答下列问题:
-
(1) 实验中发现,反应后①中的温度升高;②中的温度降低。由此判断铝条与盐酸的反应是热反应,Ba(OH)2·8H2O与NH4Cl的反应是热反应。反应过程(填“①”或“②”)的能量变化可用下图表示。
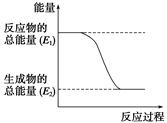
-
(2) ①中发生反应的离子方程式是;在该反应中,作为还原剂的物质是(填化学式)。
下列物质属于弱电解质的是( )
A . CO2
B . H2O
C . HNO3
D . NaOH
下列物质中属于弱电解质的是( )
A . CH3COOH
B . BaSO4
C . HCl
D . CO2
硫酸厂产生的酸性废水中含有超标的H3AsO3 , 需处理达标后才能排放。目前含砷废水的处理常用石灰中和-PFS、硫化、氧化吸附等方法。
-
(1) 石灰中和-PFS法,处理过程如下:
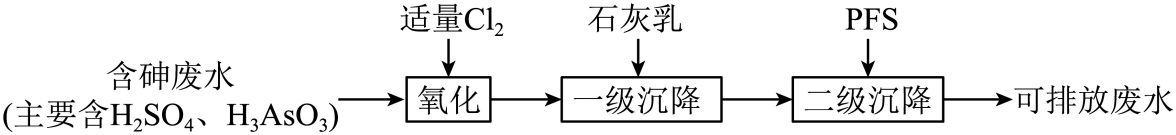
含砷废水经氧化后,加入石灰乳,在相同时间内,废水中沉降的固体、砷的去除率与溶液pH的关系如图-1所示。
 水溶液中含砷微粒的物质的量分布分数与pH的关系如图-2所示。已知此温度下,
水溶液中含砷微粒的物质的量分布分数与pH的关系如图-2所示。已知此温度下, 溶于水,
溶于水, ,
, 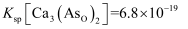 ,
,  。
。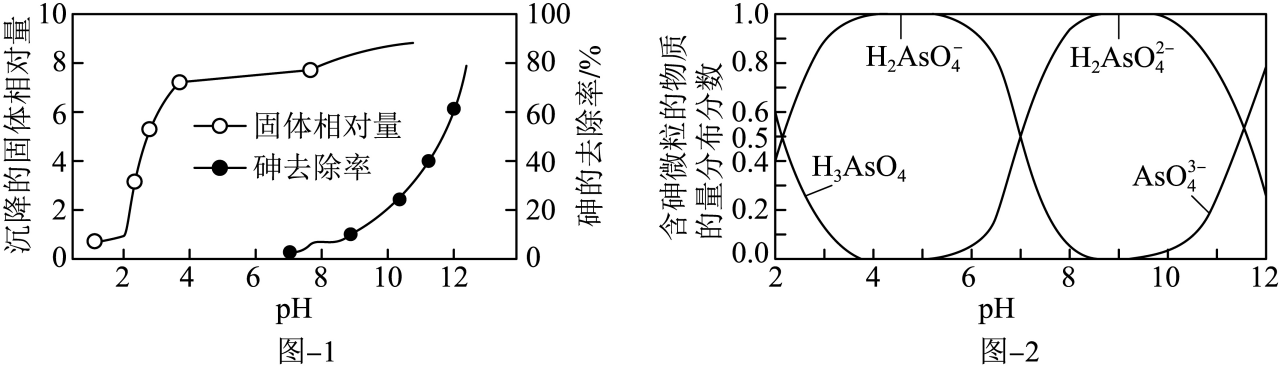
①一级沉降时,当
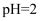 , 废水中开始产生沉淀,该沉淀主要成分的化学式为。pH调节到8时,开始产生
, 废水中开始产生沉淀,该沉淀主要成分的化学式为。pH调节到8时,开始产生 沉淀,原因是。
沉淀,原因是。②二级沉降中,保持溶液pH在8~10之间,加入PFS(聚合硫酸铁)形成的
 胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为。
胶体粒子与含砷微粒反应可提高砷的去除率,其主要反应的离子方程式为。 -
(2) 硫化法,用硫代硫酸钠 (Na2S2O3)去除酸性废水中
 的反应机理如图-3所示,
的反应机理如图-3所示, 经过“途径Ⅰ”的除砷过程可描述为(图中“HS·”为自由基,“·”表示孤单电子)。
经过“途径Ⅰ”的除砷过程可描述为(图中“HS·”为自由基,“·”表示孤单电子)。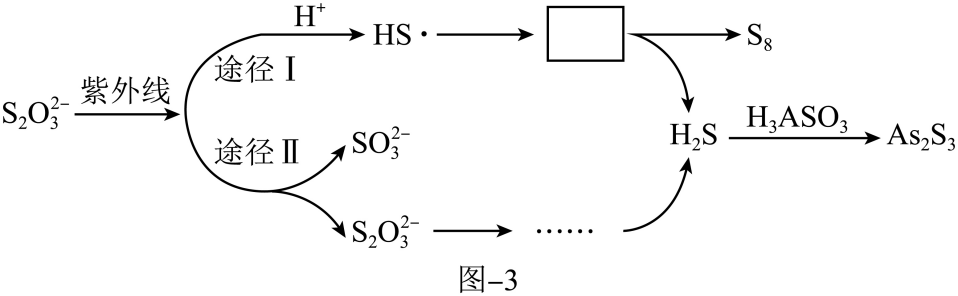
-
(3) 氧化吸附法,新生态
 悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(Ⅴ),也具有较强的吸附性,能吸附水体中的
悬浊液具有较强的氧化性,能将As(Ⅲ)氧化为As(Ⅴ),也具有较强的吸附性,能吸附水体中的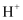 而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态
而带正电荷。所带正电荷越多,吸附含砷微粒的能力越强。pH不同时,新生态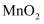 悬浊液对砷去除率如图-4所示。
悬浊液对砷去除率如图-4所示。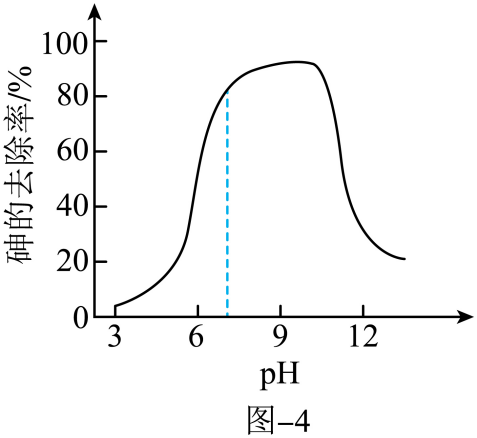
①加入新生态
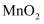 悬浊液使废水中
悬浊液使废水中 转化为
转化为 , 反应的离子方程式为。
, 反应的离子方程式为。②pH从3增大到7的过程中,随着pH增大,砷的去除率上升。其原因是。
用废铜屑(含Cu、CuO、Fe2O3等)制备胆矾的流程如图:
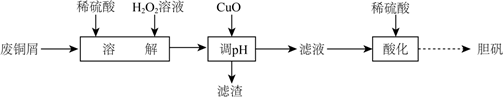
下列说法错误的是( )
A . “溶解”时,铜发生反应的离子方程式为Cu+4H++O  =Cu2++2H2O
B . “调pH"时,可用Cu2(OH)2CO3 , 代替CuO
C . “滤液”中c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2]
D . “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
=Cu2++2H2O
B . “调pH"时,可用Cu2(OH)2CO3 , 代替CuO
C . “滤液”中c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2]
D . “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
 =Cu2++2H2O
B . “调pH"时,可用Cu2(OH)2CO3 , 代替CuO
C . “滤液”中c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2]
D . “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
=Cu2++2H2O
B . “调pH"时,可用Cu2(OH)2CO3 , 代替CuO
C . “滤液”中c(Cu2+)·c2(OH-)≤Ksp[Cu(OH)2]
D . “酸化”时,加入稀硫酸的目的是抑制Cu2+的水解
最近更新