第二单元 金属钠及钠的化合物 知识点题库
-
(1) 组装该电池必须在无水、无氧的条件下进行,原因是。
-
(2) SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2 , 有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,反应的化学方程式为。用硫黄(S)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量之比为。
-
(3) 甲同学设计如图所示的装置用ZnCl2·xH2O晶体制取无水ZnCl2 , 回收剩余的SOCl2并利用装置F验证生成物中的某种气体(夹持及加热装置略)。

①用原理解释SOCl2在该实验中的作用:。
②装置的连接顺序为A→B→。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,甲同学设计实验方案如下,正确的实验顺序为(填序号)。
a.加入足量硝酸酸化的硝酸银溶液,充分反应 b.称得固体为n克c.干燥 d.称取蒸干后的固体m克溶于水 e.过滤 f.洗涤
-
(4) 乙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl2的脱水剂,但丙同学认为该实验可能发生副反应使最后的产品不纯。
①可能发生的副反应的离子方程式为。
②两同学设计了如下实验方案判断副反应的可能性:
i.取少量FeCl3·6H2O于试管中,加人足量SOCl2 , 振荡使两种物质充分反应;
ii.往上述试管中加水溶解,取溶解后的溶液少许于两支试管,进行实验验证,完成表格内容。
(供选试剂:AgNO3溶液、稀盐酸、稀HNO3、酸性KMnO4溶液、BaCl2溶液、K3[Fe(CN)6]溶液、溴水)
方案
操作
现象
结论
方案一
往一支试管中滴加
若有白色沉淀生成
则发生了上述副反应
方案二
往另一支试管中滴加
则没有发生上述副反应

-
(1) 试管中发生的化学反应方程式是。
-
(2) 指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)。
-
(3) 烧杯中发生反应的离子方程式是。
-
(4) 如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为,加CaCl2后反应的离子方程式为。

回答下列问题:
-
(1) 第②步操作中,氧化性强弱顺序:ClO3-(填“>”或“<”)MnO2 , 当NaClO3转移2 mol电子时,生成的氧化产物的物质的量为mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为。
-
(2) 第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的(填字母)。
a. NaCl b. NaClO c. NaClO4 d. NaOH
-
(3) 已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为。
-
(4) 氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的方程式为:8HClO3 = 3O2 ↑+ 2Cl2 ↑+ 4HClO4 + 2H2O,所得混合气体的平均式量为。
 2Fe+3CO2
D . 在水溶液中:CaSO4+Na2CO3=CaCO3↓+Na2SO4
2Fe+3CO2
D . 在水溶液中:CaSO4+Na2CO3=CaCO3↓+Na2SO4

-
(1) 写出B的电子式。
-
(2) 若A是一种非金属单质,且可用于制造半导体材料,写出A和B水溶液反应的离子方程式。
-
(3) 若A是CO2气体,A与B溶液能够反应,反应后所得的溶液再与盐酸反应,生成的CO2物质的量与所用盐酸体积如图2所示,则A与B溶液反应后溶液中所有溶质的化学式为;c(HCl)=mol/L。

-
(4) 若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是。
-
(5) 若A是一种可用于做氮肥的化合物, A和B反应可生成气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式为。
-
(6) 若A是一种溶液,可能含有H+、NH
 、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子是,它们的物质的量浓度之比为。
、Mg2+、Fe3+、Al3+、CO32-、SO42-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图3所示,由此可知,该溶液中肯定含有的离子是,它们的物质的量浓度之比为。 
 、Cl-、
、Cl-、 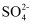 B . Al3+、H+、
B . Al3+、H+、  、ClO-
C . K+、Fe3+、
、ClO-
C . K+、Fe3+、  、OH-
D . Na+、Ca2+、Cl-、
、OH-
D . Na+、Ca2+、Cl-、 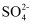
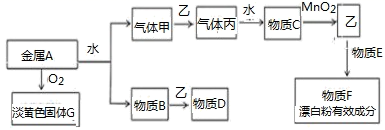
请根据以上信息回答下列问题:
-
(1) 写出下列物质的名称:丙;
-
(2) 写出下列物质的化学式:F;G。
-
(3) 气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请回答下列问题:
①气体乙通入紫色石蕊溶液中,可以观察到的现象是:, 请你解释其中的原因。
②某化学兴趣小组计划用气体乙和物质B制取简易消毒液D其反应原理为:(用化学方程式表示) 。
③实验室常用烧碱溶液吸收Cl2氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO 的物质的量之比为 3:1 的离子方程式。
 B . c(Fe3+)=2.0mol/L的溶液中:K+、Ca2+、OH-、Cl-
C . 加入酚酞显红色的溶液中:Na+、CO
B . c(Fe3+)=2.0mol/L的溶液中:K+、Ca2+、OH-、Cl-
C . 加入酚酞显红色的溶液中:Na+、CO  、NO
、NO  、K+
D . 加入铝粉能产生氢气的溶液中:Fe2+、NO
、K+
D . 加入铝粉能产生氢气的溶液中:Fe2+、NO  、K+、SO
、K+、SO 
-
(1) I.NO能被灼热的铁粉还原为N2 , 同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可将NO氧化为NO2;②NaOH溶液能与NO2反应,不与NO反应。
打开A装置分液漏斗活塞,烧瓶中观察到的实验现象有:铜片表面出现无色气泡,铜片逐渐变小、、烧瓶中溶液由无色变为蓝色。
-
(2) 上述装置接口的连接顺序为:a→→→→→g→h→b→c→d(按气流方向,用小写字母表示)。
-
(3) 装置B的作用是。
-
(4) 装置E中反应的化学方程式为。
-
(5) II.已知:(NOx)能与Na2O2反应;NO2和Na2O2都有较强氧化性。为探究NO2与Na2O2反应的产物,提出如下假设:
假设①NO2氧化Na2O2;假设②Na2O2氧化NO2
甲同学设计如图所示实验装置:

请回答下列问题:
甲乙两同学对假设分别进行了验证:
实验操作
现象
结论
甲同学
待试管G中收集满气体,向其中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管,观察现象;并将带火星的木条迅速伸进试管,观察。
红棕色气体迅速消失;木条复燃
假设①正确
乙同学
在F、G之间增加一个M洗气瓶,目的是,重复甲同学的实验操作。
红棕色气体迅速消失,带火星的木条未复燃
假设②正确
请做出正确判断,写出NO2和Na2O2反应的化学方程式。
-
(6) 图中单向阀在实现气体单向流通的同时,还有一个作用是。

已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RH2  NiR2+2H+。
NiR2+2H+。
回答下列问题:
-
(1) “酸浸”时,为加快浸出速率,提高生产效益,下列措施不合理的有___________(填标号)。A . 用机械搅拌器搅拌 B . 体积不变增加硫酸的浓度 C . 进一步球磨粉碎
-
(2) “电解”时,铜的电解电压较低,且电解速率很快,铁和铬存在形式随电解电压的变化如下表。为得到纯的NiSO4·nH2O,电解电压的范围应选择V。
电解电压/V
1.0
1.2
1.5
2.0
2.5
3.0
3.5
Fe2+
有
有
有
无
无
无
无
Cr4+
无
无
无
无
无
有
有
-
(3) 萃取余液可在中循环利用(填操作单元),反萃取剂X为(填化学式)。
-
(4) “反萃取”得到的NiSO4溶液,可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为。NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得NiSO4·nH2O。下列说法正确的是(填标号)。
A.为得到较大NiSO4·nH2O晶体颗粒,宜用冰水快速冷却结晶
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.可通过抽滤提高过滤速度,在80℃鼓风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
-
(5) 采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为;C点产物的化学式为。


已知:①辉铋矿主要成分是Bi2S3 , 还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38 , Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
-
(1) 写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式。
-
(2) 滤渣1的成分为。
-
(3) 除杂剂的作用a.调节溶液pH,b,写出一种能提高产物产量的除杂剂。
-
(4) 滤液2还可用来制备NaBiO3 , 可向滤液2中加入NaOH和NaClO溶液制取NaBiO3 , 写出该反应的离子方程式。
-
(5) 滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。

①交换膜类型为(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为。
 为原料制取纯碱流程如下图所示:
为原料制取纯碱流程如下图所示: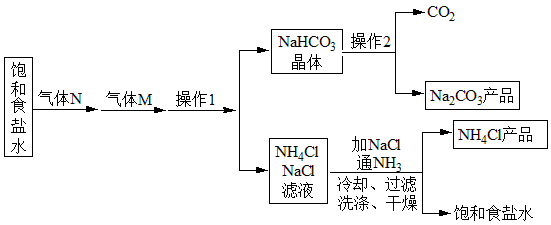
 仪器R
仪器R
下列说法正确的是( )
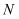 为
为 , 先通
, 先通 有利于吸收
有利于吸收 B .
B . 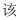 流程中只有饱和食盐水可以循环使用
C . 操作
流程中只有饱和食盐水可以循环使用
C . 操作 为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作
为过滤,为了加快过滤速度常用玻璃棒搅拌
D . 操作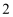 为灼烧,实验室中常在上图仪器
为灼烧,实验室中常在上图仪器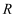 中进行
中进行
选项 | 实验操作 | 实验现象 | 实验结论 |
| 向未知液中滴加氯水,再滴加 | 溶液呈红色 | 未知液中一定含有 |
| 取无色溶液做焰色试验 | 火焰为黄色 | 无色溶液中有 |
| 某少量无色无味气体通入澄清石灰水中 | 澄清石灰水变浑浊 | 该气体一定是 |
| 将银白色的金属钠放置在空气中 | 钠表面很快变暗 | 金属钠具有强氧化性 |
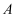 B .
B . 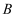 C .
C .  D .
D . 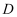
选项 | 粒子组 | 判断和分析 |
A | Al3+、H+、SO | 能共存 |
B | Na+、Cl2、OH-、Cl- | 不能共存,Cl2与OH-会反应 |
C | K+、Cu2+、S2-、SO | 不能共存,Cu2+与S2-会发生氧化还原反应 |
D | NH | 不能共存,NH |
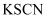 溶液
溶液
 , 无
, 无
 、NH3·H2O
、NH3·H2O 、Ba2+、NO
、Ba2+、NO 、Cl-
、Cl-


