第三单元 海洋化学资源的综合应用 知识点题库
①CuSO4•5H2O ②AgI ③溴水 ④FeSO4•7H2O⑤KMnO4溶液 ⑥碱性酚酞溶液.
-
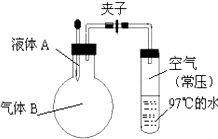
(1) 如图是用海水制取少量蒸馏水的简易装置,其原理与课本中的实验原理完全相同.装置中使用了较长的玻璃管,其作用是,烧杯中还应盛装的物质是.
-
(2) 海带中含有丰富的碘,海带提碘可将海带灼烧、溶解、煮沸、过滤得含I﹣的滤液,滤液经酸化、氧化得含单质碘的溶液.回答下列问题:
①海带灼烧时用来盛装海带的仪器是(填仪器名称)
②已知KMnO4、H2O2、Cl2等均可与I﹣反应生成I2 , 且KMnO4、H2O2、Cl2对应的生成物分别为Mn2+、H2O、Cl﹣ . 从绿色化学的角度看I﹣转化成I2 , 最好选 (上述三种中选择)
-
(3) 海水晒盐得到的盐含有较多的杂质.某学习小组欲设计实验提纯粗盐.
①若只除去其中的不溶性杂质,应经过的实验步骤是、、.
②若要进一步除去上述粗盐中的可溶性杂质,应选择合理的除杂试剂.请填写表:
杂质
CaCl2
MgCl2
Na2SO4
除杂试剂
③为确保杂质除尽,所加试剂应适当过量.如何判断SO42﹣是否除尽?
④上述除杂试剂加入的先后顺序应满足的一般条件是
⑤按顺序加入上述除杂试剂过滤后,还应加入适量稀HCl,其目的是,判断加入稀HCl适量的方法可以是.
请回答下列各题:

-
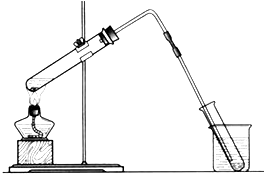
(1) 操作a的名称是;
-
(2) 固体A是,气体B是;
-
(3) 海水中的镁元素为(填“游离态“或”化合态“).
-
(1) 在工业生产中金属冶炼的原理错误的是_
A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3 来制取 Al
C CO 还原 Fe2O3 制取 Fe
D 铝热反应原理制锰:4Al+3MnO2
 3Mn+2 Al2O3
3Mn+2 Al2O3 -
(2) 下图是从海水中提取溴的简单流程:

提取溴的过程中,经过 2 次 Br-
 Br2 转化的目的是
Br2 转化的目的是 -
(3) 吸收塔中发生反应的离子方程式是
-
(4) 海带中富含碘元素,实验室从海带中提取 I2 的途径如下图所示:
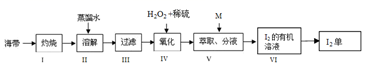
①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是 。
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③步骤 V 加入萃取剂 M 为 ,步骤 VI 从 I2 的有机溶液获得 I2 可以用 的方法。

-
(1) 海水淡化的常用方法有(请写出一种)
-
(2) 由海水提取的粗盐中含有Ca2+、Mg2+、SO
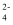 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、(填化学式),过滤之后,再加入适量盐酸。
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、(填化学式),过滤之后,再加入适量盐酸。
-
(3) 步骤1中获得Br2的离子方程式
步骤I和步骤II操作的最终目的是
-
(4) 配平步骤II操作对应的化学方程式:Br2+Na2CO3=NaBrO3+ NaBr+CO2
-
(5) 步骤Ⅲ中用H2SO4酸化处理重新得到Br2 , 写出该反应的离子方程式
若有48g溴单质生成,转移电子的物质的量为mol
-
(1) 粽子由糯米等制作而成,糯米中的淀粉是否水解完全,可用来检验。
-
(2) 与甲烷互为同系物,且含有10个碳原子的有机物分子式为。
-
(3) 海洋资源的利用具有广阔前景。
①海水淡化的方法有(填一种)。
②下图是从海水中提取镁的简单流程:

工业上常用于沉淀Mg2+的试剂A的俗名是,Mg(OH)2转化为MgCl2的离子方程式是。
-
(4) 如图所示是某同学设计的几种装置,其中能构成原电池的是(填序号)。

 , 还含有
, 还含有 以及泥沙等杂质),并进一步在实验室中制备精盐的流程如下。
以及泥沙等杂质),并进一步在实验室中制备精盐的流程如下。
-
(1) 加入过量
 溶液时发生反应的离子方程式为。
溶液时发生反应的离子方程式为。
-
(2) 试剂A是,加入它的目的是。
-
(3) 操作X的名称是,这一操作类似于“五步制盐法”中的。
-
(4) 加入适量稀盐酸的目的是。
-
(5) 操作Y中所用的陶瓷仪器是。



