第二单元 微粒之间的相互作用 知识点题库
下列物质中,既有离子键又有共价键的是( )
A . MgCl2
B . NH4Cl
C . CO2
D . H2S
最近中美科学家首次研获单层硼原子构成的“硼烯”(如图),有关“硼烯”的说法正确的是( )
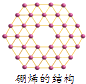
A . 是一种新型化合物
B . 与金刚石结构相似
C . 与  B互为同素异形体
D . 由共价键构成的单质
B互为同素异形体
D . 由共价键构成的单质
 B互为同素异形体
D . 由共价键构成的单质
B互为同素异形体
D . 由共价键构成的单质
用电子式表示下列物质的结构:
-
(1) NH4Cl;
-
(2) Na2O2;
-
(3) CO2;
-
(4) MgCl2;(1)~(6)中,仅含离子键的是,仅含共价键的是,既有离子键又有共价键的是.
回答下列问题:
-
(1) 在一个恒温恒容的密闭容器中,可逆反应N2(g)+3H2(g)⇌2NH3(g)
△H<0达到平衡的标志是(填编号)
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤单位时间内生成n mol N2的同时,生成3n mol H2
⑥2V(N2正)=V(NH3逆)
⑦单位时间内3mol H﹣H键断裂的同时2mol N﹣H键也断裂
⑧混合气体的平均相对分子质量不再改变
-
(2) 现有八种物质:①干冰;②金刚石;③四氯化碳;④晶体硅;⑤过氧化钠;⑥碳化硅晶体;⑦溴化钠;⑧氖.请用编号填写下列空白:
A.属于原子晶体的是,其中熔点由高到低的顺序为
B.属于分子晶体的是,其中分子构型为正四面体的化合物的电子式为
C.既含有共价键又含有离子键的化合物是,其中阳离子个数与阴离子个数之比为.
“高钙奶”中“钙”是指( )
A . 元素
B . 原子
C . 分子
D . 单质
下表是元素周期表中的一部分。
|
周期 族 |
I A |
II A |
III A |
IV B |
V A |
VI A |
VII A |
0 |
|
1 |
A |
|||||||
|
2 |
E |
F |
H |
J |
||||
|
3 |
B |
C |
D |
G |
I |
根据A~J在周期表中的位置,用元素符号或化学式回答下列问题:
-
(1) 化学性质最不活泼的元素是,氧化性最强的单质是,还原性最强的单质是.
-
(2) 最高价氧化物对应的水化物中,碱性最强的是,酸性最强的是,呈两性的是。
-
(3) A分别与E、F、G、H、I形成的简单气态化合物中,最稳定的是。
-
(4) 在B,C,D,G,I中,原子半径最大的是。
-
(5) 元素C与I形成的化合物的电子式是.
-
(6) 元素F的气态氢化物与其城高价氧化物对于的水化物反应的离子方程式。
下列表示物质结构的化学用语或模型正确的是( )
A . HF的电子式: 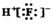 B . 用核素符号表示中子:
B . 用核素符号表示中子:  C . HClO的结构式:H-Cl-O
D . 用电子式表示CO2的形成过程:
C . HClO的结构式:H-Cl-O
D . 用电子式表示CO2的形成过程: 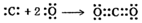
 C . HClO的结构式:H-Cl-O
D . 用电子式表示CO2的形成过程:
C . HClO的结构式:H-Cl-O
D . 用电子式表示CO2的形成过程:
下列关于离子化合物的叙述正确的是( )
A . 离子化合物中都含有离子键
B . 离子化合物中的阳离子只能是金属离子
C . 离子化合物若能溶于水,其水溶液一定可以导电
D . 溶于水可以导电的化合物一定是离子化合物
丙烷的一溴代反应产物有两种:  和
和 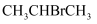 ,部分反应过程的能量变化如图所示(
,部分反应过程的能量变化如图所示( 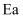 表示活化能)。下列叙述错误的是( )
表示活化能)。下列叙述错误的是( )
 和
和 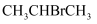 ,部分反应过程的能量变化如图所示(
,部分反应过程的能量变化如图所示( 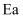 表示活化能)。下列叙述错误的是( )
表示活化能)。下列叙述错误的是( ) 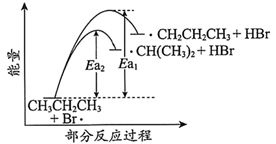
A .  丙烷中有
丙烷中有 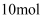 共价键
B .
共价键
B .  与
与  的反应涉及极性键和非极性键的断裂
C .
的反应涉及极性键和非极性键的断裂
C .  D . 比较
D . 比较 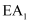 和
和  推测生成速率:
推测生成速率: 
 丙烷中有
丙烷中有 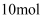 共价键
B .
共价键
B .  与
与  的反应涉及极性键和非极性键的断裂
C .
的反应涉及极性键和非极性键的断裂
C .  D . 比较
D . 比较 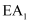 和
和  推测生成速率:
推测生成速率: 
原子序数由小到大排列的四种短周期主族元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
-
(1) 写出Y2O2的电子式:,其中含有的化学键是。
-
(2) 将ZO2通入品红溶液再加热的现象是。
-
(3) 写出X的最高价氧化物对应的水化物的稀溶液与铜反应的化学方程式。
-
(4) XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是 (填化学式)。
-
(5) 由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式。
下列说法正确的是( )
A . HF、HCl、HBr、HI的热稳定性依次递增
B . N2、CO2和CH4都是由分子构成,它们中都存在共价键,都是共价化合物
C . BCl3中各原子最外层均未达到8电子稳这结构
D . NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键
-
(1) 钡餐的化学式。
-
(2) Na2O2的电子式。
-
(3) 用电子式表示MgCl2的形成过程。
-
(4) 写出铜与稀硝酸发生反应的离子方程式。
下列只含离子键的盐是( )
A .  B .
B .  C . KClO
D .
C . KClO
D . 
 B .
B .  C . KClO
D .
C . KClO
D . 
在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的 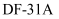 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 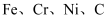 等多种元素。请回答:
等多种元素。请回答:
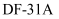 洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了
洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 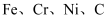 等多种元素。请回答:
等多种元素。请回答:
-
(1) 基态铁原子的价电子排布式为,
 的熔点为
的熔点为 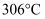 ,沸点为
,沸点为 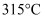 ,
,  的晶体类型是。
的晶体类型是。
-
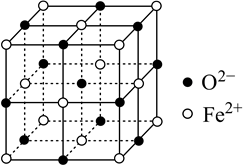
(2) 氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为
 代表阿伏加德罗常数的值。在该晶胞中,与
代表阿伏加德罗常数的值。在该晶胞中,与  紧邻且等距离的
紧邻且等距离的  数目为;
数目为;  与
与  最短核间距为
最短核间距为 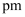 。
。 
-
(3) 硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。 ①
 中阴离子的立体构型是;
中阴离子的立体构型是;②在
 中
中 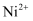 与
与  之间形成的化学键称为,提供孤电子对的成键原子是。
之间形成的化学键称为,提供孤电子对的成键原子是。 -
(4) 无水
 和氨分子作用能形成某种配合物,该配合物的组成相当于
和氨分子作用能形成某种配合物,该配合物的组成相当于  。已知:若加入
。已知:若加入  溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入
溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入  溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式,
溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式,  该配合物中含有σ键的数目为。
该配合物中含有σ键的数目为。
下列说法正确的是( )
A . H2O2中的氧原子满足最外层8电子稳定结构
B . 葡萄糖、二氧化碳和足球烯(C60)都是共价化合物,它们的晶体都属于分子晶体
C . Na2O2溶于水只需克服离子键
D . HF比HCl稳定,是由于HF分子间存在氢键
下列化学用语表述正确的是( )
A . 乙炔的实验式:CH
B . H2O2的电子式: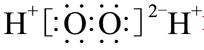 C . Mg2+的结构示意图:
C . Mg2+的结构示意图: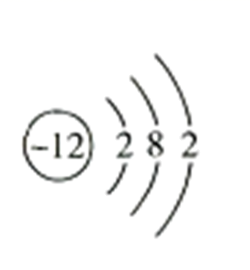 D . CO2分子的比例模型:
D . CO2分子的比例模型: 
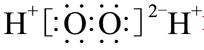 C . Mg2+的结构示意图:
C . Mg2+的结构示意图: D . CO2分子的比例模型:
D . CO2分子的比例模型: 
如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列不正确的是( )
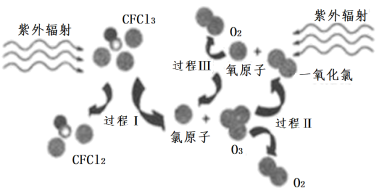
A . 过程Ⅰ中断裂极性键C-Cl键
B . 过程Ⅱ可表示为O3 + Cl = ClO + O2
C . 过程Ⅲ中O + O = O2是吸热过程
D . 上述过程说明氟利昂中氯原子是破坏O3的催化剂
下列化学用语表示错误的是( )
A . 甲烷的电子式: B . 氯乙烷的结构简式: CH3CH2Cl
C . 2−甲基−1−丁醇的键线式:
B . 氯乙烷的结构简式: CH3CH2Cl
C . 2−甲基−1−丁醇的键线式: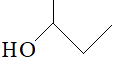 D . 乙烯的空间填充模型:
D . 乙烯的空间填充模型:
最近科学家采用真空封管法制备的磷化硼纳米颗粒,作 与
与 合成
合成 [
[
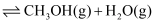 ]反应的催化剂,在发展非金属催化剂实现
]反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
 与
与 合成
合成 [
[
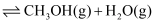 ]反应的催化剂,在发展非金属催化剂实现
]反应的催化剂,在发展非金属催化剂实现 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示(部分物质未画出)。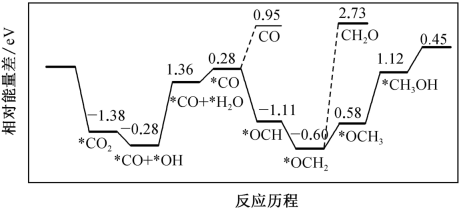
下列说法正确的是( )
A .  与
与 生成
生成 和
和 的反应为放热反应
B . 上述反应生成的副产物中,
的反应为放热反应
B . 上述反应生成的副产物中,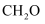 比
比 多(相同条件下)
C . 在合成甲醇的过程中,降低
多(相同条件下)
C . 在合成甲醇的过程中,降低 能量变化,可提高反应速率
D . 反应过程中有极性键和非极性键的断裂和生成
能量变化,可提高反应速率
D . 反应过程中有极性键和非极性键的断裂和生成
 与
与 生成
生成 和
和 的反应为放热反应
B . 上述反应生成的副产物中,
的反应为放热反应
B . 上述反应生成的副产物中,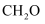 比
比 多(相同条件下)
C . 在合成甲醇的过程中,降低
多(相同条件下)
C . 在合成甲醇的过程中,降低 能量变化,可提高反应速率
D . 反应过程中有极性键和非极性键的断裂和生成
能量变化,可提高反应速率
D . 反应过程中有极性键和非极性键的断裂和生成
高技术领域常使用高纯试剂。纯磷酸(熔点为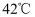 , 易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
, 易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成 (熔点为
(熔点为 ),高于
),高于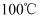 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
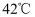 , 易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于
, 易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于 易形成
易形成 (熔点为
(熔点为 ),高于
),高于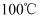 则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
-
(1) A的名称是。B的进水口为(填“a”或“b”)。
-
(2)
 的作用是。
的作用是。
-
(3) 空气流入毛细管的主要作用是防止,还具有搅拌和加速水逸出的作用。
-
(4) 升高温度能提高除水速度,实验选用水浴加热的目的是。
-
(5) 磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入促进其结晶。
-
(6) 过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为____(填标号)。A .
 B .
B . 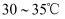 C .
C . 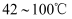
-
(7) 磷酸中少量的水极难除去的原因是。
最近更新



